Die seltene primäre pulmonale arterielle Hypertonie entwickelt sich ohne erkennbare Ursache. Durch Vasokonstriktion, Umbau (Remodeling)
arterieller Lungengefäße und thrombotische Verschlüsse nimmt der Gefäßwiderstand im Lungenkreislauf fortschreitend zu. Der erhöhte
Druck führt zur Hypertrophie und Insuffizienz des rechten Herzens. Bei Schweregrad der Klasse II oder III beträgt die durchschnittliche Lebenserwartung
dreieinhalb Jahre, bei Klasse IV ein halbes Jahr.1,2 Ursache für sekundären Lungenhochdruck sind Kollagenosen wie Sklerodermie, HIV-
Infektion, aber auch rezidivierende Lungenembolien, chronische Lungenerkrankungen und chronische Linksherzinsuffizienz. Lungenhochdruck kann außerdem
durch Arzneimittel wie zentral wirkende Appetithemmer ausgelöst werden (a-t 1996; Nr. 10: 104).
Derzeit wird die Erkrankung mit Antikoagulanzien und - bei positivem Ansprechen (20%) - mit hoch dosierten Kalziumantagonisten behandelt sowie symptomatisch mit
Sauerstoff und Diuretika. Bei schwerer pulmonaler Hypertonie können parenteral applizierte Prostazyklinderivate wie Iloprost (ILOMEDIN; keine zugelassene
Indikation) und das in Deutschland nicht eingeführte Epoprostenol (Österreich u.a.: FLOLAN) Belastungskapazität und möglicherweise auch die
Lebenserwartung erhöhen.
Seit Anfang Juni wird der per os anwendbare Endothelin-Rezeptorantagonist Bosentan (TRACLEER) zur Besserung der körperlichen Belastbarkeit und
Symptomatik bei Patienten mit pulmonaler Hypertonie der Klasse III angeboten.
EIGENSCHAFTEN: Das neuroendokrine Hormon Endothelin wirkt gefäßverengend, proliferativ, profibrotisch und
proinflammatorisch. Bei Patienten mit Lungenhochdruck sind seine Plasmaspiegel erhöht.
Die orale Bioverfügbarkeit des Endothelin-Rezeptorantagonisten Bosentan beträgt 50%. Bosentan wird über CYP 2C9 und 3A4 abgebaut und
induziert außerdem diese Enzyme. Bosentan wird mit der Galle ausgeschieden. Die terminale Eliminationshalbwertszeit beträgt etwa fünf
Stunden.2,3
KLINISCHE STUDIEN: An den beiden zulassungsrelevanten randomisierten Studien nehmen 32 bzw. 213 Patienten mit primärer pulmonaler
Hypertonie oder Lungenhochdruck im Rahmen von Kollagenosen (15% bzw. 30%) überwiegend der Klasse III teil.4,5 In beiden Studien werden
zweimal täglich 125 mg Bosentan mit Plazebo verglichen, jeweils zusätzlich zur bisherigen Therapie. In der größeren gibt es einen weiteren
Studienarm mit zweimal täglich 250 mg Bosentan. Dauertherapie mit Epoprostenol ist Ausschlusskriterium. Primärer Endpunkt ist die anhand einer
sechsminütigen Gehstrecke gemessene Belastungskapazität. In der kleineren Studie nimmt diese Strecke unter Bosentan im Vergleich mit Plazebo nach
12 Wochen von initial 360 m durchschnittlich um 76 m zu, in der größeren nach 16 Wochen von eingangs 330 m um 54 m unter der höheren Dosis
und um 35 m unter der niedrigeren. Die Effekte der beiden Dosierungen unterscheiden sich nicht signifikant. Ein günstiger Einfluss auf die Sterblichkeit ist nicht
belegt. Daten zur Lebensqualität liegen nicht vor.
UNERWÜNSCHTE WIRKUNGEN: Bosentan wirkt hepatotoxisch. Nach US-amerikanischer Fachinformation steigen Transaminasen unter der
empfohlenen Dosis von zweimal täglich 125 mg bei etwa 11% der Patienten auf mindestens das Dreifache und bei 2% auf mindestens das Achtfache der Norm.
Bei 0,3% findet sich gleichzeitig ein Bilirubinanstieg auf mindestens das Dreifache der Norm.6 Die Transaminasen müssen vor Behandlungsbeginn und
anschließend mindestens monatlich kontrolliert werden. Mäßige bis schwere Leberfunktionstörungen sind Gegenanzeigen.2
Häufig ist zudem mit Kopfschmerzen (22%), Nasopharyngitis (11%), Flush (9%), Ödemen (8%), Hypotonie (7%), Palpitationen (5%), Müdigkeit (4%) und
Juckreiz (4%) zu rechnen.2,6 In Studien zur Herzinsuffizienz bleibt ein Nutzen von Bosentan aus, weil sich das Befinden der Patienten durch
Ödembildung verschlechtert.7
Da Bosentan über CYP3A4 und 2C9 verstoffwechselt wird und diese Enzyme gleichzeitig induziert, ist ein verzögerter Abbau bei gleichzeitiger Einnahme
von CYP-3A4- und 2C9-Hemmstoffen wie Ciclosporin (SANDIMMUN) oder Ketoconazol (NIZORAL) zu erwarten sowie ein Wirkverlust gleichzeitig verwendeter Mittel,
die durch die CYP-Induktion forciert abgebaut werden, wie hormonelle Kontrazeptiva, Statine, Warfarin [COUMADIN] u.a. Bei Einnahme oraler Antikoagulanzien ist
die INR* engmaschig zu überwachen.2
Ähnlich wie andere Endothelin-Rezeptorantagonisten wirkt Bosentan im Tierversuch teratogen. Ein Klasseneffekt wird vermutet.6 Frauen im
gebärfähigen Alter dürfen das Mittel nur einnehmen, wenn eine Schwangerschaft nachweislich ausgeschlossen ist und sie eine zuverlässige,
nicht hormonelle Verhütungsmethode verwenden.2
DOSIS UND KOSTEN: Zur Erhaltungstherapie werden nach Aufdosierung mit der halben Dosis über vier Wochen zweimal täglich 125 mg
empfohlen. 56 Tabletten zu 62,5 mg bzw. 125 mg kosten jeweils 3.498 Euro, die Behandlung pro Monat 3.748 Euro.
 Seit Juni wird für die lebensbedrohliche pulmonale Hypertonie mit dem
Endothelin-Rezeptorantagonisten Bosentan (TRACLEER) ein neues Behandlungsprinzip angeboten. Seit Juni wird für die lebensbedrohliche pulmonale Hypertonie mit dem
Endothelin-Rezeptorantagonisten Bosentan (TRACLEER) ein neues Behandlungsprinzip angeboten.
 Bosentan ist nur bei primärer pulmonaler Hypertonie und bei Lungenhochdruck
im Rahmen von Kollagenosen und nur als Zusatz zur Standardtherapie geprüft. Bosentan ist nur bei primärer pulmonaler Hypertonie und bei Lungenhochdruck
im Rahmen von Kollagenosen und nur als Zusatz zur Standardtherapie geprüft.
 Zusätzliches Bosentan verlängert bei Patienten mit Schweregrad Klasse
III eine 6-minütige Gehstrecke um etwa 10% bis 20%. Zusätzliches Bosentan verlängert bei Patienten mit Schweregrad Klasse
III eine 6-minütige Gehstrecke um etwa 10% bis 20%.
 Der Einfluss auf die Prognose und die Wirksamkeit im Vergleich mit Prostazyklinen
sind unbekannt. Der Einfluss auf die Prognose und die Wirksamkeit im Vergleich mit Prostazyklinen
sind unbekannt.
 Dem marginalen, für Betroffene aber potenziell relevanten Nutzen stehen die
Lebertoxizität und Teratogenität sowie die hohen Kosten gegenüber. Dem marginalen, für Betroffene aber potenziell relevanten Nutzen stehen die
Lebertoxizität und Teratogenität sowie die hohen Kosten gegenüber.
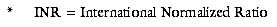

|