ZOLEDRONAT (ZOMETA): PROPHYLAXE VON KNOCHENMETASTASEN BEI BRUSTKREBS?
Eine Patientin berichtete mir, ihr behandelnder Gynäkologe habe ihr die zweimal jährliche Infusion von 4 mg Zoledronat zur Prophylaxe von Knochenmetastasen empfohlen. Bei der Patientin wurde vor zweieinhalb Jahren ein Mammakarzinom Stadium T1N1, Herceptin-Rezeptor positiv und Hormonrezeptor negativ, diagnostiziert. Jede Infusion kostet die Patientin knapp 500 €. Gibt es Belege für dieses Vorgehen?
Dr. med. A. THONKE (Facharzt f. Innere Med., Naturheilverf., Sportmed.)
D-65779 Kelkheim
Interessenkonflikt: keiner
Die Bisphosphonate Clodronat (BONEFOS u.a.), Ibandronat (BONDRONAT), Pamidronat (AREDIA, Generika) und Zoledronat (ZOMETA) sind zugelassen zur Prävention skelettbezogener Komplikationen (pathologische Frakturen, Wirbelkompressionen u.a.) bei fortgeschrittener Tumorerkrankung mit Befall des Knochens sowie zur Behandlung der tumorinduzierten Hyperkalzämie. Insbesondere für Clodronat und Zoledronat werden darüber hinaus seit Längerem verschiedene krebshemmende Effekte diskutiert, beispielsweise dass sie die Apoptose von Tumorzellen fördern oder deren Invasion und Proliferation hemmen.1 Zu Clodronat liegen inzwischen mehrere Studien bei Frauen mit primär operablem oder fortgeschrittenem Brustkrebs vor (siehe auch a-t 1998; Nr. 9: 82-3), die zu widersprüchlichen Ergebnissen kommen. Bei metaanalytischer Auswertung lässt sich jedoch weder für die adjuvante Therapie noch bei metastasiertem Mammakarzinom ein signifikanter Effekt des Bisphosphonats auf das Gesamtüberleben oder das Überleben ohne Knochenmetastasen bzw. ohne Absiedlungen in anderen Organen errechnen.2
Zu Zoledronat gab es bislang neben tierexperimentellen Daten lediglich Pilotstudien mit wenigen Patienten, die an verschiedenen fortgeschrittenen soliden Tumoren oder multiplem Myelom erkrankt waren. Kürzlich hat eine österreichische Arbeitsgruppe jedoch mit der ABCSG*-12-Studie1 eine große Untersuchung zum Nutzen des Aromatasehemmers Anastrozol (ARIMIDEX) im Vergleich zum Standardmittel Tamoxifen (NOLVADEX, Generika) bei prämenopausalen Frauen mit Hormonrezeptor-positivem nichtmetastasiertem Brustkrebs vorgelegt. Die zwischen 1999 und 2008 durchgeführte offene Studie prüft gleichzeitig im faktoriellen Design (a-t 2008; 39: 119) eine Zusatzbehandlung mit Zoledronat.
| * | ABCSG = Austrian Breast and Colorectal Cancer Study Group |

1.800 Frauen erhalten innerhalb von acht Wochen nach der Operation für einen Zeitraum von drei Jahren den LH-RH-Agonisten Goserelin (ZOLADEX; 3,6 mg s.c. alle vier Wochen) sowie entweder Tamoxifen (20 mg/Tag) oder Anastrozol (1 mg/Tag), jeweils mit oder ohne Zoledronat (4 mg i.v. alle sechs Monate**). Laut Publikation im New England Journal of Medicine1 ist der primäre Endpunkt der Studie das krankheitsfreie Überleben, wobei zum einen Anastrozol und Tamoxifen verglichen werden und zum anderen Zoledronat mit endokriner Therapie allein. Der Einfluss der Behandlungen auf das Gesamtüberleben wird als sekundärer Endpunkt ausgewertet, explorativ wird zudem der Effekt von Zoledronat auf das Überleben frei von Knochenmetastasen analysiert. Nach medianer Nachbeobachtung von vier Jahren (Datenstand vom 31. März 2008) lässt sich für Anastrozol weder hinsichtlich des krankheitsfreien noch beim Gesamtüberleben ein Vorteil gegenüber Tamoxifen belegen. Numerisch schneidet der Aromatasehemmer in beiden Auswertungen schlechter ab. Zoledronat erhöht dagegen das krankheitsfreie Überleben signifikant, beeinflusst das Gesamtüberleben jedoch nicht. Ein Effekt auf die Rate der Knochenmetastasen (1,8% vs. 2,5% unter endokriner Therapie allein) lässt sich statistisch ebenfalls nicht nachweisen.1
| ** | Die Dosis von Zoledronat wurde im Studienverlauf gesenkt, wobei die Angaben für die Begründung und die ursprüngliche Dosis variieren: Laut aktueller Publikation1 wurden zunächst 8 mg/4 Wochen angewendet. Die Änderung erfolgte demnach, weil mit der neuen Dosis in anderen Studien ein Aromatasehemmer-induzierter Knochenverlust verhindert wurde. In einer Zwischenanalyse zur Knochendichte (angegebene Dosis: 8 mg/6 Monate) wird als Grund "Berichte über verschlechterte Nierenfunktion unter der 8-mg-Dosis" genannt.7 |
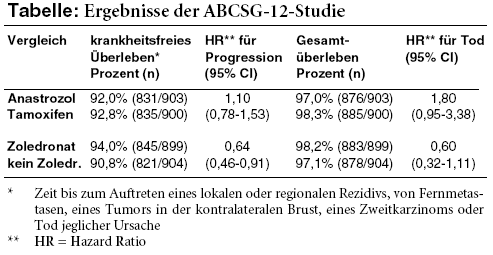
Das für das Bisphosphonat auf den ersten Blick positiv wirkende Ergebnis hat dazu geführt, dass beispielsweise in der Brustkrebsleitlinie der Arbeitsgemeinschaft Gynäkologische Onkologie (AGO) Zoledronat bereits als Therapieoption bei prämenopausalem nichtmetastasiertem Mammakarzinom empfohlen wird.3 Einschränkend wird dort jedoch festgestellt, dass die in der Studie verwendete adjuvante Therapie nicht dem Standard entspricht. In der Tat werden in Leitlinien fünf Jahre Tamoxifen empfohlen,4,5 in der ABCSG-12-Studie wurde das Antiöstrogen jedoch nur drei Jahre lang eingenommen. Aber die Studie hat einen weiteren eklatanten Mangel, der ihre Aussagekraft erheblich einschränkt:
Nach Angaben, die im Februar 2006, also nach knapp siebenjähriger Laufzeit der insgesamt neunjährigen Studie, im US-amerikanischen Studienregister ClinicalTrials.gov veröffentlicht wurden, war als primärer Endpunkt ursprünglich nur der Vergleich von Anastrozol und Tamoxifen im Hinblick auf krankheitsfreies Überleben und zusätzlich auch Gesamtüberleben vorgesehen. Für Zoledronat sollte demnach in einer Substudie primär lediglich dessen Einfluss auf die Knochendichte bestimmt werden.6 Dies wird auch in einer 2007 von der Arbeitsgruppe veröffentlichten Zwischenanalyse zur Knochendichte so beschrieben.7 Potenzielle Effekte von Zoledronat auf krankheitsfreies und Gesamtüberleben sollten ursprünglich als sekundäre Endpunkte ausgewertet werden.6 Erst im Juli 2008, mehr als drei Monate nach Datenschluss, werden primärer und sekundärer Endpunkt in ClinicalTrials.gov so verändert,8 wie sie in der aktuellen Publikation erscheinen.1 Dass der primäre onkologische Endpunkt wesentlich verändert wurde, sodass aus einer gemäß dem ursprünglichen Studienplan negativen Studie eine zumindest zum Teil positive Studie wurde, wird in der Publikation im New England Journal1 verschleiert. Aus den vernebelnden Angaben in der Web-Appendix zur Studie ("the study protocol is not completely precise with regard to the definition of the primary goal") kann man zwar erahnen, dass der primäre Endpunkt nachträglich geändert wurde, man erhält jedoch auch hier keine klare Auskunft, wie er ursprünglich definiert war und wann und warum die Änderungen vorgenommen wurden.
In der ABCSG-12-Studie bleibt der Aromatasehmemmer Anastrozol (ARIMIDEX) bei prämenopausalen Frauen mit nichtmetastasiertem Brustkrebs gegenüber dem Standard Tamoxifen (NOLVADEX, Generika) ohne Vorteil hinsichtlich des krankheitsfreien und des Gesamtüberlebens.
Die gleichzeitig im faktoriellen Design geprüfte Zusatzbehandlung mit dem Bisphosphonat Zoledronat (ZOMETA) erhöht das krankheitsfreie Überleben signifikant. Ein Einfluss auf die Gesamtsterblichkeit und die Rate der Knochenmetastasen lässt sich nicht belegen.
Durch nachträgliche Änderung des primären onkologischen Endpunktes wurde aus einer ohne diese Änderung negativen Studie eine zumindest zum Teil positive Studie: Primär sollten ursprünglich lediglich Anastrozol und Tamoxifen im Hinblick auf das krankheitsfreie und das Gesamtüberleben verglichen werden. Primärer Endpunkt für Zoledronat war dessen Einfluss auf die Knochendichte. Dieser Sachverhalt wird in der Publikation der Studie verschleiert, Angaben zum Zeitpunkt der Änderung fehlen. Ein Jahr vor dem Ende der neunjährigen Studie beschreiben die Autoren in einer anderen Publikation noch das ursprünglich vorgesehene Design.
Die ABCSG-12-Studie bleibt auch deswegen ohne Aussagekraft, weil die verwendete endokrine Therapie nicht dem Standard entspricht: Sie sah eine lediglich dreijährige Einnahme von Tamoxifen anstelle der empfohlenen fünf Jahre vor.
Das Ergebnis zu Zoledronat bedarf daher der Bestätigung in einer korrekt durchgeführten, möglichst verblindeten Studie von ausreichender Größe und Dauer, um auch den Einfluss auf die Gesamtsterblichkeit bestimmen zu können.
Beim derzeitigen Kenntnisstand raten wir Frauen mit nichtmetastasiertem Mammakarzinom von der Anwendung von Zoledronat außerhalb klinischer Studien ab.
| (R = randomisierte Studie, M = Metaanalyse) | ||
| R | 1 | GNANT, M. et al.: N. Engl. J. Med. 2009; 360: 679-91 |
| M | 2 | HA, T.C., LI, H.: Brit. J. Cancer 2007; 96: 1796-801 |
| 3 | AGO: Diagnosis and treatment of patients with primary and metastatic breast cancer, Bisphosphonates, Stand 18. März 2009; http://www.ago-online.de/download/g_mamma_09_1_0_26_bisphosphonates.pdf | |
| 4 | AGO: Diagnosis and treatment of patients with primary and metastatic breast cancer, adjuvant endocrine therapy in premenopausal patients, Stand 18. März 2009; http://www.ago-online.de/download/g_mamma_09_1_0_ 01_adj_endo_therapy_premenopausal_patients.pdf | |
| 5 | Deutsche Krebsgesellschaft: Interdisziplinäre S3-Leitlinie Mammakarzinom, Stand 2008; http://www.krebsgesellschaft.de/download/interdiszipl._s3-ll_mamma_080211.pdf | |
| 6 | ClinicalTrials.gov: Studie NCT00295646, Stand 23. Febr. 2006 http://clinicaltrials.gov/archive/NCT00295646/2006_02_23 | |
| R | 7 | GNANT, M. et al.: J. Clin. Oncol. 2007; 25 : 820-8 |
| 8 | ClinicalTrials.gov: Studie NCT00295646, update vom 3. Juli 2008 http://clinicaltrials.gov/archive/NCT00295646/2008_07_03/changes |
© 2009 arznei-telegramm, publiziert am 3. April 2009
Autor: angegebene Leser bzw. Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
