NEURAMINIDASEHEMMER: DIE ZWEIFEL MEHREN SICH
Im Zuge der jüngsten Diskussion um die Schweinegrippe, die Rolle der Weltgesundheitsorganisation (WHO) und der an der Pandemieplanung beteiligten Experten, von denen einige erhebliche Interessenkonflikte hatten oder noch haben (a-t 2010; 41: 59-60), werden auch neue Details zur Zulassung der Neuraminidasehemmer Oseltamivir (TAMIFLU) und Zanamivir (RELENZA) bekannt. Nicht zuletzt angesichts zunehmender Ängste vor einer jederzeit drohenden Influenzapandemie wurden Ende der 1990er Jahre große Erwartungen in diese neue Klasse antiviral wirkender Mittel gesetzt (z.B. "Medizinsensation: Grippe endlich besiegt"1). Die Zulassung in den USA und Europa verlief jedoch holperig:
Für Zanamivir, den ersten angebotenen Neuraminidasehemmer, wurden die Daten in den USA als so unzureichend eingestuft, dass sich das zuständige Beraterkomitee mit 13 zu 4 Stimmen gegen eine Zulassung aussprach. Auch der Statistiker der Arzneimittelbehörde FDA, der die Daten zu Zanamivir ausgewertet hat, war gegen die Zulassung.2 Gründe dafür gab es mehrere: Von den drei zulassungsrelevanten Phase-III-Studien verlief die größte negativ, und bei Risikopatienten traten dort Komplikationen unter Zanamivir tendenziell häufiger auf als unter Plazebo. In dieser in Nordamerika durchgeführten Untersuchung war der Gebrauch symptomatisch wirkender Mittel wie Parazetamol (BEN-U-RON, Generika) doppelt so hoch wie in der Studie mit dem größten Behandlungseffekt. Die dritte Untersuchung lag jeweils dazwischen. Die inverse Beziehung zwischen Einnahme symptomatisch wirkender Mittel und Behandlungseffekt deutet nach Ansicht des FDA-Mitarbeiters auf einen Zusammenhang hin.2 Die gleichzeitige Anwendung könnte die Effekte von Zanamivir überdecken.3 Eine weitere Kritik betraf den primären Endpunkt der Studien, die Zeit bis zur Linderung der Beschwerden, sowie das statistische Verfahren: Beide führen zu einer massiven Überschätzung des Behandlungseffekts, weil beispielsweise eine erneute Verschlechterung der Symptome nach Erreichen des primären Endpunktes - was bei bis zu einem Drittel der Patienten vorkam - nicht in die Auswertung einging.2 In behördeneigenen Analysen lässt sich für den Neuraminidasehemmer praktisch kein Effekt erkennen (Abbildung).
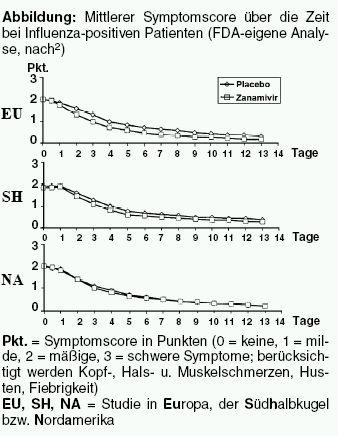
Die Leitung der FDA entschied sich jedoch dafür, Zanamivir dennoch zuzulassen - um im Falle einer Pandemie etwas auf dem Markt zu haben, so der FDA-Statistiker.3 Ursprünglich sollte er auch die Beurteilung von Oseltamivir übernehmen. Nachdem er und das Beraterkomitee sich jedoch gegen die Zulassung von Zanamivir ausgesprochen hatten, wurde diese Aufgabe jemand anderem übertragen. Nach seiner Einschätzung ebnete die Zulassung von Zanamivir den Weg für den zweiten Neuraminidasehemmer.3 Das im Unterschied zu Zanamivir oral anwendbare Oseltamivir wurde wenig später ohne größere Probleme in den USA zugelassen, wenn auch die klinische Relevanz des "bescheidenen Nutzens" im FDA-Review als "höchst subjektive Frage" bezeichnet wurde.4
In Europa waren es die Nutzenbelege für Oseltamivir, die für Probleme bei der europäischen Zulassungsbehörde EMA sorgten (vgl. a-t 2000; 31: 70). Einer der beiden Berichterstatter, ein Mitarbeiter der finnischen Arzneimittelbehörde, schildert, dass mehrere Treffen des wissenschaftlichen Ausschusses der EMA stattfanden, in denen es vor allem um die auch heute noch diskutierten Probleme der klinischen Relevanz einer Verkürzung der Krankheitsdauer um einen Tag und den fraglichen Einfluss auf Sekundärkomplikationen einer Influenza ging (siehe auch a-t 2010; 41: 4,13-4).3 Zwei der hinzugezogenen Experten des belgischen Gesundheitsministeriums bzw. des schwedischen Instituts für Infektionskrankheiten hatten finanzielle Verbindungen zum Oseltamivir-Hersteller Roche. Ob sie den Interessenkonflikt deklarierten, bleibt offen: Auf entsprechende Anfrage des British Medical Journal haben sie ausweichend bzw. gar nicht geantwortet. Und die EMA war "außer Stande", die Erklärungen zu potenziellen Interessenkonflikten dieser beiden Experten für das Jahr 2002 vorzulegen.3 Primärer Endpunkt und Analyseverfahren bei den Oseltamivir-Studien entsprechen übrigens im Wesentlichen denen der Zanamivir-Studien, sodass auch hier der ohnehin klinisch wenig relevante Nutzen noch überschätzt sein dürfte, -Red.
| 1 | BZ vom 10. Okt. 1998 |
| 2 | FDA: Statistical Review RELENZA (Zanamivir), 1999 http://www.accessdata.fda.gov/drugsatfda_docs/nda/99/021036-stats.pdf |
| 3 | COHEN, D., CARTER, P.: BMJ 2010; 340: c2912 |
| 4 | FDA: Medical Review Oseltamivir, Okt. 1999; http://www.accessdata.fda.gov/drugsatfda_docs/nda/99/21087_Tamiflu_medr_P1.pdf |
© 2010 arznei-telegramm, publiziert am 16. Juli 2010
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
