Anfang Oktober 1993 erhielt Bundesminister SEEHOFER vom Bundesgesundheitsamt (BGA) eine Liste mit 373 Berichten zu Blutprodukten "mit den
Nebenwirkungen HIV-positiv, Serokonversion positiv, HTLV3-Test positiv, AIDS, erworbenes Immundefektsyndrom (auch Verdachtsfälle)". In der
Aufstellung wird die HIV-Infektion überwiegend einzelnen Blutderivaten angelastet. Zum Teil sind jedoch bis zu sechs verschiedene Mittel als
"verdächtigt" eingestuft. Wir schlüsseln in den folgenden Tabellen auf, wie häufig die betroffenen Blutzubereitungen allein angeschuldigt
werden (erste Zahl in der Klammer) oder in Verbindung mit weiteren verdächtigten Blutprodukten (zweite Zahl in der Klammer hinter dem Schrägstrich)
genannt sind.
Die genannten Präparate* –
Empfänger gezielt nachuntersuchen |
Zahl der Meldungen |
Antihämophiles Humanplasma
Antihämophiles Kryopräzipitat
ANTITHROMBIN III (Alpha)
CYTOTECT**,**** (Biotest)
Erythrozytenkonzentrat
FACTORATE HT (Armour)
Faktor VIII ANTIHAEMOPHILIC
Faktor VIII HS
FAKTOR VIII-
HT HYLAND (Travenol)
Faktor VIII Konzentrat
FAKTOR VIII S-TIM 2 IMMUNO (Immuno)
Faktor IX
FAKTOR IX BEHRING (Behring)
FAKTOR IX
COMPLEX HUMAN
FAKTOR IX HS BEHRING (Behring)
FAKTOR IX S-TIM 4 IMMUNO (Immuno)
FEIBA (Immuno)
FIBRACCEL (Behring)
FIBROGAMMIN (Behring)
Frischplasma/FFP
HAEMATE (Behring)
HAEMATE HS (Behring)
HUMANALBUMIN BEHRING**** (Behring)
HUMAN FIBRINOGEN BEHRING (Behring)
Immunglobulin****
IMMUNINE STIM PLUS FAKTOR IX (Immuno)
KYBERNIN (Behring)
KYBERNIN
HS (Behring)
LYOPLASMA FRISCHPLASMA LYOPHILISIERT
Plasma
PPSB Konzentrat
PPSB KONZENTRAT BEHRING (Behring)
PROTHROMBIN KONZENTRAT BEHRING (Behring)
Prothrombin Konzentrat PPSB
SANDIMMUN (Sandoz)***
Vollblut |
1
25
2
1
6
1
45
1
2
12
1
2
1
3
1
1
2
3
2
251
8
1
7
1
1
6
1
1
3
41
2
13
19
1
4 |
(0/1)
(0/2)
(0/1)
(1/5)
(1/0)
(0/45)
(0/1)
(2/0)
(5/7)
(0/1)
(2/0)
(1/0)
(0/3)
(1/0)
(0/1)
(0/1)
(0/2)
(1/2)
(0/2)
(196/55)
(5/3)
(0/1)
(1/6)
(0/1)
(0/1)
(0/6)
(0/1)
(0/1)
(0/3)
(34/7)
(1/1)
(7/6)
(14/5)
(1/0)
(0/4) |
| Betroffene Blutzubereitungen* |
Albumin****
Blutgerinnungsfaktoren
Erythrozytenkonzentrate
Immunglobuline****
Plasma/FFP
Vollblut |
1
453
6
2
6
4 |
(0/1)
(289/164)
(1/5)
(0/2)
(0/6)
(0/4) |
| Betroffene Hersteller* |
Armour Pharma GmbH
Behringwerke AG
Bezirksinstitut für Blutspende
und Transfusionswesen Berlin
Biotest Pharma
GmbH
Immuno GmbH
Sandoz AG
Travenol GmbH |
2
344
1
3
4
1
2 |
|
* | Die BGA-Liste läßt zahlreiche Fragen offen (siehe folgenden Artikel). Die von den
Herstellern vorgenommene Kennzeichnung verdächtigter Präparate wurde offensichtlich vom Amt bearbeitet. Zum Teil sind die Angaben nicht konsistent.
So wird bei einem Patienten mit AIDS, der 1983 HAEMATE erhielt, das Datum des Auftretens der Schadwirkung (UAW) mit 1977 angegeben. Bei fast jedem
fünften Bericht fehlt ein Datum des Eintritts der UAW. Dieser Mangel erscheint bei der relativ guten ärztlichen Kontrolle von Blutern schwer
verständlich. |
** | Bei dem in der BGA-Liste als verdächtigt genannten Misoprostol-Ulkusmittel
CYTOTEC dürfte es sich um einen Schreibfehler handeln. Gemeint ist offensichtlich das Zytomegalie-Immunglobulin CYTOTECT. |
*** | Kein Blutderivat, sondern aus einem Pilz gewonnenes Ciclosporin-haltiges
Immunsuppressivum, dennoch als allein verdächtigt gekennzeichnet. |
**** | Anschuldigung derzeit nicht nachvollziehbar. |
Mit 344 HIV-Infektionen, die Blutderivaten der Behringwerke angelastet werden, führt die Hoechst-Tochter mit Abstand die Liste der betroffenen Hersteller
an. Es mag sich dabei um ein Artefakt handeln, weil die Firma im Gegensatz zu anderen die Meldepflicht anscheinend ernst nahm, wenn z.B.
Entschädigungsansprüche von HIV-Infizierten geltend gemacht wurden. Eine Fußnote unter der vom BGA vorgenommenen Auswertung nach
Herstellern läßt auf herstellerfreundliche Interpretation schließen:
"Die genannten Zahlen treffen keine Aussage über die Qualität der Blutprodukte, da die Art der Produkte unterschieden und die Meldebereitschaft
berücksichtigt werden müssen. So hat sich insbesondere die Firma Behring frühzeitig um zuverlässige Inaktivierungsverfahren
bemüht."
Diese Anmerkung veranschaulicht die Dimension des Problems. Wenn so viele Infektionen selbst bei dem Hersteller auftreten, der frühzeitig für
zuverlässige Virusinaktivierungsverfahren gesorgt haben soll, ist bei den Blutgerinnungsfaktoren und sonstigen Blutderivaten der übrigen Hersteller eine
hohe Dunkelziffer anzunehmen. Die meisten Firmen, allen voran Immuno (Heidelberg/Wien), und das DRK kommen offensichtlich ihrer Verpflichtung zur Meldung
unerwünschter Wirkungen nicht nach, ohne daß im BGA etwas dagegen getan wird.
Aufklärungsbedürftig bleiben Lücken in der BGA-Dokumentation. Für das Faktor-IX-Konzentrat PPSB BIOTEST ordnete das BGA im April 1990
das Ruhen der Zulassung an, weil bei sieben Patienten mit Hämophilie B unter Anwendung des Präparates eine HIV-Serokonversion beobachtet wurde
(vgl. a-t 5 [1990], 50/Seite 105 dieser Ausgabe). Die zwischenzeitlich auf elf angewachsenen Berichte zu PPSB
BIOTEST lassen sich in der BGA-Liste ebensowenig ausmachen wie Blutgerinnungsfaktor-VIII-haltige Arzneimittel des Landesverbandes des DRK Niedersachsen,
Oldenburg und Bremen, für die das BGA wegen HIV-1/2-Übertragungsrisiko ein Stufenverfahren zur Risikoabwehr eingeleitet hat (Bundesgesundheitsamt,
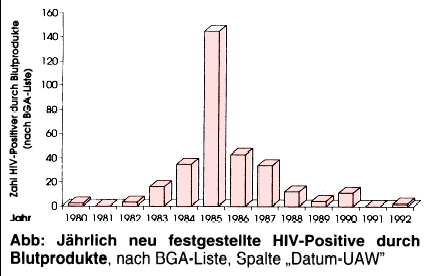
Tätigkeitsbericht, MMV München, 1993, S. 435). Nach Anordnung eines Tests zum Ausschluß von Blutspendern mit HIV-Infektion im Oktober 1985
fällt die Zahl der Meldungen neuer HIV-Infektionen durch Blutprodukte in den Folgejahren auffällig langsam ab (vgl. Abb.) – die nachvollziehbare
Folge fehlender Rückrufe ungetesteter Ware.
WIDERSPRÜCHE IN DER BGA-LISTE
... die Kunst der Desinformation
FAZIT: Die verspätet dem zuständigen Ressortminister vom BGA überantwortete sogenannte Mitternachtsliste gibt keinen Anhalt für das
Ausmaß der Gefährdung der HIV-Übertragung durch aus menschlichem Plasma hergestellte Medikamente. Wer in den letzten zehn Jahren
Blutprodukte wie die in der BGA-Liste genannten Mittel erhalten hat, sollte gezielt nachuntersucht werden (HIV-Antikörper-Test), wenn nachweislich der
Krankenblätter ein derartiges Präparat angewendet wurde. Betroffen sein können Personen mit bekannten Gerinnungsstörungen oder
größeren Blutverlusten, Operationen, Biopsien/Laparoskopien, Nachgeburtsblutungen u.a. in diesem Zeitraum.
Richtigstellung: In der sogenannten "Mitternachtsliste" mit 373 Meldungen zu Blutprodukten in Verbindung mit HIV-Infektionen (a-t-Sonderausgabe 10 [1993], 101) werden Antithrombin-Präparate genannt, neben KYBERNIN auch generisch bezeichnetes
Antithrombin III. ANTITHROMBIN III der Firma Alpha ist in der Liste nicht aufgeführt, –Red.
|

