Ingrid Mühlhauser, Renate Kimmerle, Michael Berger
Klinik für Stoffwechselkrankheiten und Ernährung (WHO-Collaborating Centre for Diabetes), Heinrich-Heine Universität Düsseldorf *
* |
Adresse: Priv.-Doz. Dr. med. Ingrid Mühlhauser, Dr. med. Renate Kimmerle, Prof. Dr. med. Michael Berger, Heinrich-
Heine Universität Düsseldorf, Klinik für Stoffwechselkrankheiten und Ernährung, Moorenstraße 5, D-40225
Düsseldorf
|
Zusammenfassend kann die Kritik an einer Langzeittherapie mit Sexualhormonen in der Postmenopause zur Krankheitsverhütung und
Lebensverlängerung folgendermaßen dargestellt werden: Kontrollierte Interventionsstudien mit den Endpunkten Herzinfarkte, Schenkelhalsfrakturen,
Endometrium- und Mammakarzinome und Mortalität liegen zur Zeit nicht vor. Drei randomisierte Studien zur präventiven Hormontherapie mit
Beobachtungszeiten von drei bis zu neun Jahren wurden kürzlich in den USA begonnen.89 Ergebnisse werden somit erst in einigen Jahren zur
Verfügung stehen. Die Validität der verfügbaren Kohorten- und Fall-Kontroll-Studien ist aufgrund der Selektionsproblematik und des Compliance-
Phänomens zugunsten einer Dauerbehandlung von Frauen in einem nicht beurteilbaren Ausmaß eingeschränkt. Langzeitstudien für
verschiedene Hormonkombinationen, Hormonpräparate und -dosierungen fehlen. Für eine präventive Langzeit-Behandlung von Frauen in der
Postmenopause mit Hormonen zur Verringerung der kardiovaskulären Morbidität gibt es derzeit keine naturwissenschaftliche Grundlage. Wegen der
möglichen Gefahren, Nebenwirkungen und Kosten ist ein derartiger medikamentöser Ansatz zur Dauerprävention von Herz-Kreislauferkrankungen in
der weiblichen Bevölkerung in der Postmenopause zur Zeit abzulehnen.
Am Beispiel des Diabetes mellitus wurde gezeigt, daß die Erkenntnislage zu möglichen erwünschten und unerwünschten Wirkungen einer
Hormontherapie besonders bei Hochrisikogruppen für kardiovaskuläre Erkrankungen limitiert und widersprüchlich ist. Die Durchführung einer
Sexualhormon-Behandlung zur Prävention von kardiovaskulären und Skelett-Erkrankungen und zur Lebensverlängerung ist bei Patientinnen mit
Diabetes mellitus zur Zeit nicht vertretbar.
Die Information von Ärzten und Frauen über eine präventive Langzeit-Hormonbehandlung sollte eine verständliche und umfassende Darstellung
nicht nur der hypothetischen positiven Wirkungen, sondern auch möglicher unerwünschter Wirkungen beinhalten.
Während der letzten zwei Jahre wurden im Deutschen Ärzteblatt mehrere Konsensuspapiere58,59,62 und andere Berichte106
zur Therapie mit Östrogenen/Gestagenen in der Menopause und Postmenopause publiziert, die über die Behandlung von Menopausebeschwerden
hinaus die präventive Langzeit-Behandlung möglichst aller Frauen ab dem Zeitpunkt der Menopause fordern. Die Autoren gehen sogar soweit, die
Ärzteschaft dazu aufzufordern, die vom Bundesgesundheitsamt (BGA) vorgegebenen und in den Beipackzetteln aufgeführten Kontraindikationen zu
ignorieren.58,59,62 Die offenen Fragen und die internationale Kontroverse zur präventiven Langzeit-Hormontherapie werden dabei nicht erwähnt
oder geleugnet. Dagegen wird ein Konsensus präsentiert, der weitere Diskussionen beenden soll: Die deutschen Frauen sollen nicht verunsichert und
verängstigt werden. Die Schuld für die bisher noch nicht ausreichend weite Verbreitung der Hormontherapie wird den Beipackzetteln und dem
Bundesgesundheitsamt zugeschrieben. Diese werden verantwortlich gemacht für: "Verunsicherung der Frauen", "Störung des
Vertrauensverhältnisses zwischen Arzt und Patientin", mit den Folgen "häufige Ablehnung der Substitution bzw. ihre vorzeitige
Beendigung" und "weitreichende und langfristige Konsequenzen für die Gesundheit der Frauen", sowie schließlich "ungünstige
Auswirkungen auf die Prävention von Volkskrankheiten wie Osteoporose, Atherosklerose und Herzinfarkt" und "sinnlose Vergeudung privater und
öffentlicher Gelder". Als eine mögliche Lösung für das Problem der Beipackzettel wird angeboten: "in einigen Ländern gibt es
sie gar nicht".62 Erreicht das Eifern ein derartiges Ausmaß, drängt sich der Verdacht auf, daß es im Gegensatz zu dem vorgetragenen
Konsensus sehr wohl eine Kontroverse zu diesem Thema gibt.95 In der Tat wird die präventive Langzeittherapie mit Östrogenen/Gestagenen in
der internationalen Literatur außerordentlich kontrovers diskutiert.12,33,37,63,83,89,99,102,103
Der Wunsch der Öffentlichkeit nach objektiver und verständlicher Information ist groß. Sowohl Ärzteschaft als auch die Frauen wollen in
ausgewogener Weise über Nutzen und Risiko einer Behandlung informiert werden. Nur so können sie eine sog. informierte Entscheidung ("informed
decision") treffen.31 Eine informierte Entscheidung kann durchaus auch eine Ablehnung einer Empfehlung bedeuten. Die umfassende und
nachvollziehbare Darstellung des Nutzen-Risiko-Verhältnisses wird besonders dann gefordert, wenn es um die medikamentöse Langzeitbehandlung einer
gesunden Bevölkerungsgruppe zum Ziel einer Primär-Prävention geht. Die ethisch-moralischen Aspekte einer solchen Intervention erfordern eine
öffentliche Diskussion und dürfen nicht von einer selbsternannten Gruppe sog. Experten für die Betroffenen entschieden werden.31,94-
96
Frauen mit Diabetes mellitus haben ein sehr hohes kardiovaskuläres Risiko und wären aus diesem Grund nach den erwähnten Empfehlungen
besonders für eine präventive Hormontherapie geeignet. Andererseits galt bisher gerade der Diabetes mit seinen vaskulären Komplikationen als eine
absolute bzw. relative Kontraindikation für eine Hormonbehandlung. In diesem Artikel sollen verschiedene Aspekte der Kontroverse um die präventive
Langzeit-Hormonbehandlung von Frauen in der Postmenopause mit besonderer Berücksichtigung der Risiko-Konstellation des Diabetes mellitus dargestellt
werden. Es soll beispielhaft aufgezeigt werden, in welcher Form Ärzte und Frauen über den hypothetischen Nutzen und die Risiken einer solchen
Behandlung informiert werden könnten.
Langzeittherapie mit Sexualhormonen zur Prävention kardiovaskulärer Erkrankungen
Was wird in Aussicht gestellt? In den erwähnten deutschen (Konsensus)publikationen58,59,62,106 wird eine Primär- und
Sekundär-Prävention kardiovaskulärer Erkrankungen durch die Langzeit-Hormontherapie in der Postmenopause postuliert und propagiert. So
heißt es unter anderem: "Durch ihre Wirkungen auf den Fettstoffwechsel und die Gefäße verhindern Östrogene in hohem Maße die
Atherosklerose"; "bei ausreichend hohen Östrogenspiegeln ist ein ungünstiger Effekt der Gestagene auch bei bestehenden
Herz-/Kreislauferkrankungen – nicht zu erwarten"; "Im Gegenteil, für einige dieser (im Beipackzettel als Kontraindikationen aufgeführten
– Ergänzung der Autoren) Krankheiten besteht geradezu eine Indikation zur Anwendung natürlicher Östrogene, gegebenenfalls in Kombination
mit einem Gestagen, zum Beispiel Bluthochdruck, Herz-/Kreislauferkrankungen und Fettstoffwechselstörungen (Typ II und III)".58 "Am
Nutzen postmenopausaler Östrogensubstitution zur kardiovaskulären Protektion gibt es keinen Zweifel",106 "Östrogene in
Substitutionsdosen senken den Blutdruck und bewirken keine Gewichtszunahme".62 Ein Expertengremium der Deutschen Gesellschaft für
Endokrinologie stellte 1988 fest: "Keine Kontraindikation besteht bei Hypertonus, Hyperlipidämie, Diabetes mellitus, Varikosis".26
Was sind die Fakten? 1. Kontrollierte Interventionsstudien fehlen: Aufgrund von Metaanalysen (= "pooling" von vielen Studien) wurde gefolgert,
daß das Risiko kardiovaskulärer Erkrankungen für Frauen, die jemals Östrogene eingenommen hatten, um 35-45% (relativ %) reduziert
war.36 Diese Metaanalysen basieren ausschließlich auf epidemiologischen Observationsstudien (Kohortenstudien,
Querschnittsuntersuchungen, Fall-Kontroll-Studien). Solche Studien sind nicht geeignet, die Effektivität einer Behandlung nachzuweisen.91 Ein solcher
Beweis kann nur durch prospektive randomisierte Interventionsstudien erfolgen. Die einzige kontrollierte randomisierte Studie zum Einfluß einer
Östrogenbehandlung zur Sekundär-Prävention kardiovaskulärer Erkrankungen erfolgte bei Männern im Coronary Drug Project.22-
24 In dieser Studie wurden Männer im Alter zwischen 30 und 65 Jahren mit Zustand nach Myokardinfarkt untersucht. Zur Cholesterinsenkung erhielt eine
Studien-Gruppe 5 mg und eine zweite Gruppe 2,5 mg konjugierter Östrogene pro Tag. Die Studie mußte wegen schwerer unerwünschter Wirkungen
abgebrochen werden. Trotz Cholesterinsenkung war es nach 18 Monaten unter 5 mg Östrogen zu einer Zunahme von Myokardinfarkten um 100%, von
Pulmonalembolien um 300% und der Letalität um fast 20% gekommen. Auch unter 2,5 mg Östrogen waren Nebenwirkungen häufiger als unter
Placebo. Obwohl diese Untersuchung bei Männern durchgeführt wurde und die verwendeten Hormondosen um das 3- bis 5fache höher lagen, als
sie zur Behandlung von Frauen in der Postmenopause verwendet werden, darf sie hier nicht unberücksichtigt bleiben, da auch jetzt wieder Hormontherapien
gerade für jene Frauen gefordert werden, die ein ähnliches Risikofaktorenprofil haben wie die Männer im Coronary-Drug-Project, und zwar ohne
daß kontrollierte Interventionsstudien vorliegen.
2. Behandlungs-Selektion in epidemiologischen Studien: Durch Metaanalysen wird die Aussagekraft von epidemiologischen Untersuchungen zur
präventiven Hormontherapie nicht verbessert, wenn die gepoolten Studien den Fehler der Nicht-Vergleichbarkeit der Gruppen teilen. So werden
gesündere Frauen häufiger mit Hormonen behandelt als kranke Frauen.12,33,83,89,102 Dafür sprechen folgende Beobachtungen:
Bisher galten kardiovaskuläre Erkrankungen als absolute oder relative Kontraindikationen für eine Verabreichung von Hormonen, sei es in Form der
Antikonzeptiva, aber auch bei der deutlich niedriger dosierten Hormonbehandlung in der (Post-)menopause. Dies könnte ein Grund dafür sein, daß in
den großen amerikanischen Kohortenstudien bei Frauen, die in der (Post_)Menopause Hormone einnahmen, weniger häufig als bei anderen Frauen ein
Diabetes oder eine Hypertonie vorlagen.25,66,77, 98,101,109 In fast allen epidemiologischen Studien unterschieden sich Frauen, die Hormone einnahmen,
durch eine Vielzahl weiterer Merkmale von Frauen ohne Hormontherapie, so z.B. durch einen höheren Sozialstatus, höheres Einkommen, höhere
Schulbildung, gesundheitsbewußteres Leben, häufigere Arztbesuche, mehr sportliche Betätigung, höheren Alkoholkonsum, niedrigeres
Körpergewicht mit niedrigerer waist-to-hip-ratio und weniger Begleiterkrankungen.8,12,18,33,66,77,83,88, 102,109 Alles dies sind wohlbekannte
Faktoren, die unabhängig von jeglicher Hormontherapie mit einem niedrigeren kardiovaskulären und Mortalitäts-Risiko verbunden sind. Auch schon
vor der Hormonbehandlung wiesen Frauen, die mit Hormonen behandelt wurden, bezüglich der klassischen kardiovaskulären Risikofaktoren ein
günstigeres Profil auf als Frauen ohne eine solche Behandlung.11,18,25,109 In der Framingham-Studie wurden die Assoziationen zwischen
Östrogeneinnahme und kardiovaskulärer Morbidität und Mortalität bei 1234 Frauen über eine Dauer von 8 Jahren
untersucht.27,34,107,108 Frauen mit Östrogentherapie hatten einen niedrigeren Blutdruck, ein niedrigeres Gewicht und niedrigere Cholesterinwerte,
und zwar nicht nur während der Östrogeneinnahme, sondern auch schon vorher. Trotzdem hatten in dieser Studie Frauen mit Östrogentherapie eine
signifikant erhöhte kardiovaskuläre Morbidität und mehr Schlaganfälle.107,108 Das Risiko war besonders hoch für rauchende
Frauen.107 Heute wird argumentiert, daß die Östrogentherapie damals zu hoch dosiert wurde.98 Andererseits haben diese Studien dazu
beigetragen, bereits bestehende kardiovaskuläre Erkrankungen und Zigarettenrauchen als (relative) Kontraindikationen für eine Hormontherapie
einzustufen.
Auch andere Befunde sprechen für eine selektionierte Behandlung relativ gesünderer Frauen mit Östrogenen. So zeigt sich immer wieder, daß
nicht nur die kardiovaskuläre Morbidität bei Frauen mit Hormonbehandlung niedriger ist, sondern auch die Gesamtmortalität und die Karzinom-
Mortalität,83,103 z.B. im Lipid Research Clinics Program17 oder der Rancho-Bernardo Studie.25
Wie sich die geforderte Behandlung auch von Frauen mit bereits bestehenden kardiovaskulären Erkrankungen bzw. thromboembolischen Komplikationen
auswirken wird, kann derzeit nicht beurteilt werden. Frauen mit kardiovaskulären Erkrankungen wurden aus vielen Studien bzw. Analysen dieser Studien
ausgeschlossen.98,77 Auch fehlen adäquate Informationen zur Sicherheit einer Langzeittherapie mit Sexualhormonen bei Frauen über 60
Jahren.
Eine Indikation zur Anwendung von Östrogenen oder Östrogen-Gestagen-Präparaten als Antihypertensiva oder als Medikamente zur
Sekundärprävention nach Myokardinfarkt, vergleichbar etwa den Betablockern oder der Azetylsalizylsäure, gibt es bisher nicht.
3. Gesichtspunkte zur Bedeutung der "compliance": Frauen, die (langfristig) eine Therapie mit Sexualhormonen durchführen,
repräsentieren eine selektionierte Gruppe. Sie werden als "compliant" bezeichnet und jenen Frauen gegenübergestellt, die eine Hormontherapie
(entgegen ärztlicher Empfehlungen) gar nicht erst beginnen oder vorzeitig abbrechen. Die postulierte Protektion der Östrogentherapie wird von solchen
Kohorten von Frauen abgeleitet, die zur Hormontherapie "compliant" sind. Die causa für diese zunächst rein statistische Assoziation mag
jedoch eine ganz andere sein als protektive Effekte der Östrogene. Dafür sprechen Erkenntnisse der Compliance- und Placebo-
Forschung.91,94,97 Eine bemerkenswerte Beobachtung verdanken wir dem bereits erwähnten Coronary Drug Project, einer prospektiven
randomisierten Interventionsstudie, in der die Effekte verschiedener Medikamente auf die kardiovaskuläre Morbidität und Mortalität bei Männern
untersucht wurden.23
Ein wesentliches Studienergebnis war, daß der Lipidsenker Clofibrat im Vergleich zu Placebo keine positiven Effekte hatte.22 In beiden
Studiengruppen betrug die 5-Jahres-Mortalität 20 bis 21%. In einer post-hoc Analyse wurde geprüft, ob nicht doch positive Effekte zumindest bei jenen
Patienten zu beobachten wären, die zur Einnahme von Clofibrat "compliant" waren. Tatsächlich fand sich bei diesen Studienteilnehmern eine
um etwa 40-50% niedrigere Mortalität als bei Personen, die die Clofibrat-Therapie vorzeitig beendet hatten bzw. unterdosiert hatten. Vollständig unerwartet
war jedoch, daß dieselben Ergebnisse auch für die Placebogruppe zutrafen, d.h. Studienteilnehmer, die zur Einnahme von Placebo "compliant"
waren, hatten ebenfalls eine um 40-50% niedrigere Mortalität als Personen, die die Placebo-Therapie vorzeitig beendet hatten bzw. unterdosiert
hatten.22 Ein ähnliches Phänomen zeigte sich auch im sog. Beta Blocker Heart Attack Trial.51
Erklärungen für dieses Phänomen sind spekulativ. Eine mögliche Erklärung könnte folgende sein: Nimmt man an, daß
tatsächlich weder Untersuchern noch Studienteilnehmern bekannt war, wer die Testsubstanz (Verum) und wer Placebo erhielt, werden in beiden
Patientengruppen die gleichen Faktoren wirksam, die die Compliance zur Einnahme eines Medikaments bedingen. Eine hohe Compliance wird von jenen Patienten
erreicht, die nicht nur bei Beginn, sondern auch während der gesamten Studienzeit davon ausgehen, daß die Medikamenteneinnahme für sie von
Nutzen ist. Dieser Motivationsaspekt bleibt erhalten, solange sich die Patienten gesund und wohl fühlen und unter dem Eindruck stehen, das Medikament helfe
und schade nicht. Dies gilt sowohl für Verum als auch für Placebo. In dem Augenblick, in dem Studienteilnehmer jedoch Beschwerden oder
Komplikationen entwickeln, wird der Glaube (von Patienten, Angehörigen, Ärzten) an das Medikament erschüttert, eventuell werden die
Beschwerden sogar darauf zurückgeführt und die Medikamente, egal ob Verum oder Placebo, werden nicht mehr regelmäßig genommen oder
abgesetzt. Dazu gehören dann vermehrt jene Patienten, die trotz Verum oder Placebo kardiovaskuläre Komplikationen entwickeln und folglich auch eine
höhere Mortalität haben. Dieser Mechanismus könnte gerade für Studien zur Langzeitbehandlung mit Östrogenen besonders relevant sein.
Frauen, die sich gesund fühlen, weil sie gesund sind und es auch bleiben, mit oder ohne Östrogene, werden aus präventiven Gründen eher
langfristig Hormone einnehmen als Frauen, die sich krank fühlen und Symptome entwickeln, gleichgültig ob diese auf die Hormontherapie oder auf
unabhängig davon auftretende Erkrankungen zurückzuführen sind. In Kohortenstudien werden daher Frauen, die langfristig Östrogene
einnehmen, als gesünder imponieren, auch wenn kein Kausalzusammenhang zwischen Östrogeneinnahme und dem Gesundheitszustand der Frauen
besteht.
4. Problematik der Übertragbarkeit von Studienergebnissen aus den USA: Die meisten Untersuchungen aus den USA beziehen sich auf die
Verwendung von natürlichen konjugierten Östrogenen. Die alleinige Verwendung von Östrogen ist aber in Deutschland wegen des Risikos des
Endometriumkarzinoms nur bei Frauen nach Hysterektomie gestattet.4 Statt dessen sind Östrogen-Gestagen-Kombinationen zu verwenden. Zu diesen
Kombinationsbehandlungen liegen jedoch nur wenige und widersprüchliche Untersuchungen vor.29,84,88,89 Da für Gestagene ungünstige
Effekte auf Glukose- und Lipid-Stoffwechsel und Blutdruck beschrieben wurden,32,28,49 könnten die postulierten positiven Wirkungen einer reinen
Östrogentherapie durch eine Kombination mit Gestagenen abgeschwächt oder aufgehoben werden.33,36,83,89,102 Während in den USA
überwiegend Kombinationen aus natürlichen konjugierten Östrogenen und Medroxyprogesteron, einem Progesteron-Abkömmling, verwendet
werden,47,90 gibt es in Europa Präferenzen für Östrogene wie Estradiol und Estradiolvalerat und für synthetische Gestagene, die sich
vom Testosteron ableiten, wie Norethisteronacetet, Levonorgestrel, Norgestrel.93 Langzeit-Wirkungen und -Sicherheit der vorwiegend in Europa
verwendeten Östrogene und Gestagene sind noch weniger bekannt als jener Präparate, die in den amerikanischen Studien verwendet wurden.
Langzeit-Untersuchungen zu den in Deutschland zunehmend populären Hormonpflastern93 auf kardiovaskuläre Komplikationen fehlen
vollständig. Auch unterschiedliche Dosierungen und Kombinationen der Hormone, z.B. kontinuierliche versus zyklische Verabreichung, könnten sich
langfristig sehr unterschiedlich auf Herz-Kreislaufkomplikationen auswirken.89,102
Hormontherapie zur Prävention der Osteoporose
Was wird in Aussicht gestellt? "Die Osteoporose kann verhindert werden".59 Es wird impliziert, daß alle – vor allen Dingen die
sturzabhängigen – Frakturen, einschließlich Vertebralfrakturen, Radius- und Humerusfrakturen und die besonders gefürchteten
Oberschenkelhalsfrakturen verhindert werden können.
Was sind die Fakten? Randomisierte Studien über bis zu 10 Jahre zeigen, daß die Knochendichte durch Östrogentherapie erhalten
bleibt.63 Kontrollierte Studien zur Inzidenz von Oberschenkelhalsfrakturen fehlen. Aufgrund epidemiologischer Studien wurde gefolgert, daß es unter
Östrogentherapie zu 25-50% weniger Frakturen kommt. Diese Beobachtungen wurden an relativ jungen Frauen (meist unter 75 Jahre) gemacht und sind nicht
ohne weiteres auf ältere Frauen übertragbar.63 Mehr als 80% der Frakturen treten jedoch erst bei über 75jährigen Personen auf. Der
Knochendichte-erhaltende Effekt der Östrogene ist zudem nur solange nachweisbar, wie die Behandlung durchgeführt wird. So zeigte sich in der
Framingham-Studie bei über 75 Jahre alten Frauen, daß, selbst wenn 10 Jahre oder länger Östrogene eingenommen, danach aber abgesetzt
wurden, die aktuelle Knochendichte nicht höher war als bei Frauen, die nie Östrogene eingenommen hatten.30 Auch bei Frauen mit
prämenopausaler Oophorektomie zeigte sich 4 Jahre nach Beendigung der Östrogen-Substitutionstherapie eine Knochendichte wie bei
Placebobehandlung.64 Um Knochenbrüche im hohen Alter durch eine Östrogentherapie zu verhindern, müßte diese also
postmenopausal lebenslang durchgeführt werden. Die heute durchzuführende kombinierte Östrogen-Gestagentherapie ist vergleichsweise wenig
untersucht; gleichwohl wird postuliert, daß auch unter dieser Behandlung die Knochendichte erhalten bleibt und Knochenbrüche verhindert werden
können.1,20,39,87
Im folgenden soll an einem Beispiel gezeigt werden, wie im Rahmen einer ausgewogenen Information für Ärzteschaft und Frauen der Zusammenhang
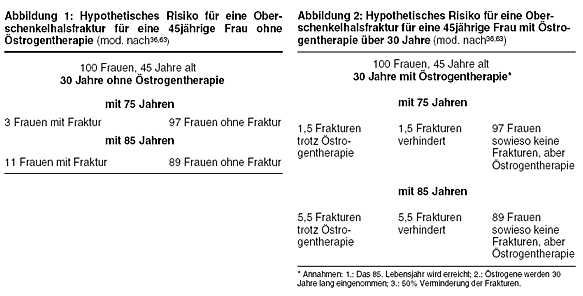
zwischen Östrogentherapie und Prävention von Oberschenkelhalsfrakturen verdeutlicht werden könnte (Tabelle 1 und Abb. 1). Die Darstellung
bezieht sich auf verschiedene Publikationen.36,63 Demnach ist für eine 45jährige Frau das Lebenszeitrisiko für eine
Oberschenkelhalsfraktur 3%, wenn sie 75 Jahre alt wird, und 11%, wenn sie 85 Jahre alt wird. Von 100 45jährigen Frauen, die das 85. Lebensjahr erreichen,
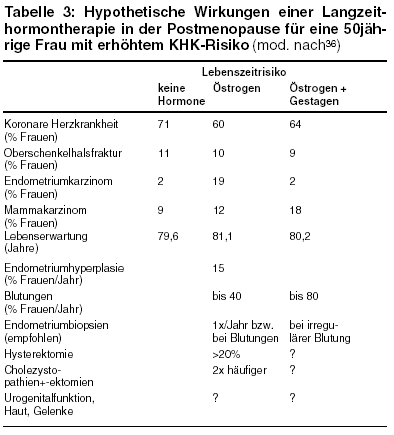
werden somit 11 eine Fraktur erleiden, 89 jedoch nicht. Schätzungen zufolge können Oberschenkelhalsfrakturen durch eine Östrogentherapie bis zu
50% reduziert werden. Abb. 2 zeigt diese hypothetischen Effekte einer Östrogentherapie. Der Berechnung zugrunde gelegt wurde eine kontinuierliche
Östrogenbehandlung über 30 Jahre. Demnach würden 5 bis 6 Frauen tatsächlich die Oberschenkelhalsfraktur verhindert haben, entsprechend
einer Reduktion um 50%, 5 bis 6 Frauen würden aber trotzdem eine Oberschenkelhalsfraktur erleiden, und 89 Frauen hätten zwar 30 Jahre lang
präventiv die Hormontherapie durchgeführt, hätten aber ohnehin niemals eine Oberschenkelhalsfraktur bekommen.
Es ist derzeit kaum möglich, für die einzelne Frau das Risiko vorherzusagen, ob sie Knochenbrüche erleiden wird oder nicht. Genetische
Faktoren scheinen eine wichtige Rolle zu spielen72,73 und sind ein zusätzliches Argument gegen den undifferenzierten Einsatz der präventiven
Hormontherapie bei der Gesamtbevölkerung der Frauen. Die Densitometrie als Screeningverfahren ist außerhalb von Hochrisiko-Populationen
ungeeignet46,63,60,75 und verursacht durch ihren unkritischen Masseneinsatz durch zahlreiche falsch positive Diagnosen vielfältige Probleme. Dazu
gehören Ängste bei den betroffenen Frauen, von den Kosten für die Versicherungsträger ganz zu schweigen. Diese Art der
Verängstigung, verbunden mit möglicherweise unnötiger (medikamentöser) Behandlung und nicht gerechtfertigter Bindung an medizinische
Institutionen, muß der vermeintlichen Verunsicherung der Bevölkerung durch umfassende Information über Wirkungen und Nebenwirkungen der
präventiven Hormontherapie entgegengehalten werden.

Zur ausgewogenen Information gehört auch die Darstellung alternativer Möglichkeiten zur Prävention derOsteoporose und von
Oberschenkelhalsfrakturen.19,38,61,63, 86 Starkes Zigarettenrauchen antagonisiert die Wirkungen von Östrogen und führt zu einem
beschleunigten Knochenabbau auch schon in der Prämenopause.56,63 Das Sturzrisiko im hohen Alter hängt vor allen Dingen von Faktoren ab,
die von der Osteoporose und auch von deren Therapie oder Prävention völlig unabhängig sind, z. B. Sehstörungen, neurologische
Erkrankungen, Gehstörungen durch Gon- und Coxarthrosen, Morbus Parkinson, Z. n. Apoplex, Alkohol, Psychopharmaka, aber auch Verwendung
ungeeigneter Bodenbeläge in Wohnungen und Altenheimen. Zu den wichtigsten vermeidbaren Ursachen für Brüche im höheren Lebensalter
zählen Immobilisation und die Verwendung von Tranquilizern oder Schlafmitteln.63 Außerdem kann den Frauen (und Männern) in Aussicht
gestellt werden, daß sie, sollten sie tatsächlich ein hohes Lebensalter erreichen, auch dann noch wirksam Oberschenkelhalsfrakturen verhindern
können, z.B. durch einen Hüftgelenksschutz.61
Mammakarzinom und Endometriumkarzinom als Nebenwirkungen der Therapie mit Sexualhormonen
Was wird in Aussicht gestellt? "Es gibt keinen Beweis ... für eine Erhöhung des Risikos eines Mammakarzinoms durch eine
Östrogen-Gestagen-Substitution".58 "Nur für die allmonatliche sequentielle Östrogen-Gestagen-Substitution und für die
kombinierte Östrogen-Gestagenzufuhr ist nachgewiesen, daß das Risiko des Endometriumkarzinoms nicht erhöht ist"; "bei
Östrogen-Monotherapie (ohne Gestagenzusatz) und eine in Abständen (von 3 bis 6 Monaten) gegebene Gestagenzufuhr wurde das bisher nicht
nachgewiesen".61
Was sind die Fakten? Tatsächlich gibt es keinen Beweis durch eine kontrollierte prospektive Interventionsstudie für eine Erhöhung des
Risikos eines Mammakarzinoms durch eine Östrogen- oder Östrogen-Gestagen-Behandlung in der (Post-)Menopause. Allerdings gibt es
Observationsstudien und Fall-Kontroll-Studien einschließlich Meta-Analysen, die einen solchen Zusammenhang zeigen.14,21,36,100 Damit wird die
Frage nach der Beweispflicht entscheidend. Diese ist eindeutig zu beantworten: Die Protagonisten der Hormontherapie müssen den Beweis erbringen, daß
diese Behandlung das Karzinomrisiko nicht erhöht. Dies ist um so mehr zu fordern, als die Hormontherapie eine präventive Intervention darstellt, die bei
gesunden Frauen erfolgen soll und deren positive Effekte auf Morbidität und Mortalität hypothetisch sind, da kontrollierte Interventionsstudien mit diesen
Endpunkten fehlen.
Aufgrund epidemiologischer Analysen nimmt die Häufigkeit des Mammakarzinoms in den USA unerwartet rasch zu. Seit 1940 stieg die Inzidenz des
Mammakarzinoms kontinuierlich um 1% pro Jahr an, Mitte der 80er Jahre gab es jedoch einen abrupten Anstieg, die Zunahme hatte 1987 4% pro Jahr
erreichen.67 In den USA muß zur Zeit eine von 8 Frauen, die das 80. Lebensjahr erreichen, damit rechnen, daß bei ihr ein Mammakarzinom diagnostiziert
wird. Die Ursachen für die Zunahme des Mammakarzinoms sind nicht bekannt. Sie können jedenfalls nicht nur durch eine verbesserte Diagnostik
erklärt werden. Aktuelle Hypothesen konzentrieren sich (wieder) auf die Östrogene als wesentliche Risikofaktoren für das
Mammakarzinom.67 In diesem Zusammenhang ist erwähnenswert, daß auch das Körpergewicht der AmerikanerInnen deutlich zugenommen
hat, was zu einem Anstieg der Östrogenspiegel geführt haben dürfte.57 Zusätzlich ist zu berücksichtigen, daß sich in den
USA derzeit Millionen Frauen mit Hormonen behandeln.47,90 Aufgrund dieser Beobachtungen wäre ein kausaler Zusammenhang zwischen der
Zunahme der Mammakarzinome und der zunehmenden Verbreitung der Hormontherapie denkbar.
Epidemiologische Untersuchungen einschließlich Metaanalysen zum Mammakarzinomrisiko unter Hormontherapie kommen zu unterschiedlichen Ergebnissen.
21,36, 48,100 Für Frauen, die aktuell mit Östrogenen behandelt werden, wurde ein um 25%36 bis 40%21
erhöhtes Risiko errechnet und für eine Hormontherapie von mehr als 10 bis 15 Jahren ein um 20% bis 30% erhöhtes Risiko.36,100
Neue Östrogene und Östrogen-Gestagen-Therapien sind kaum untersucht.48 In einer epidemiologischen Studie aus Schweden
wurden unter Östrogen-Gestagen-Therapie Erhöhungen des Mammakarzinomrisikos bis auf 440% (um das 4,4 fache) gefunden.14 Frauen mit
starkem Übergewicht entwickeln häufiger ein Mammakarzinom als schlanke Frauen.92 Eine zusätzliche Risikoerhöhung um nur 25%
bis 40% durch eine Hormontherapie würde bei diesen Frauen zu einer deutlichen Zunahme des Mammakarzinoms in Absolutzahlen führen.
Das Lebenszeit-Risiko, ein Endometriumkarzinom zu entwickeln, beträgt für eine 50-jährige Frau 2,6%.36 Das Risiko erhöht sich mit
zunehmender Dauer der Östrogentherapie und erreicht nach 8 Jahren 822% (relativ) entsprechend einem Lebenszeitrisiko von 21% (absolut).36 Aus
diesem Grund müssen heute Östrogene mit Gestagenen kombiniert werden, wenn die Frauen nicht hysterektomiert sind. Für die kombinierte
Östrogen-Gestagentherapie nimmt man an, daß das Lebenszeitrisiko für das Endometriumkarzinom nicht erhöht ist,36 obwohl es auch
hierzu widersprüchliche Mitteilungen gibt.104
Andere (Neben-)Wirkungen der Hormontherapie
Was wird in Aussicht gestellt? "Atrophische Veränderungen am Urogenitaltrakt und deren Folgeerscheinungen ... werden durch
Östrogentherapie beseitigt. Funktionelle Blasenstörungen lassen sich günstig beeinflussen"; "... vorteilhafte Auswirkungen auf Haut und
Schleimhäute (Mund, Nase, Auge), ... haben günstige Wirkungen auf Muskel und Gelenke, es kommt zur Besserung von Myalgien und Arthralgien
..."; "Nachteilige Auswirkungen auf die Gesundheit sind von einer angemessenen (in Bezug worauf – die postulierten präventiven Effekte oder
Verhinderung von unerwünschten Nebenwirkungen? – Anmerkung der Autoren) Substitution mit Östrogenen und Gestagenen nicht zu
erwarten",58 "... die Überwachung des Endometriums mit der Messung der Dicke der Gebärmutterschleimhaut ist eine wertvolle Hilfe
... ist das Endometrium hoch und die Struktur irregulär oder treten atypische verstärkte und verlängerte Blutungen auf, so ist eine Abrasio
erforderlich",62 "Manche Frauen vertragen orale Gestagene nicht, fühlen sich unter Gestagenzusatz schlechter oder zeigen
unerwünschte Nebenwirkungen wie Kopfschmerzen, Müdigkeit, depressive Verstimmungen, Brustspannung".62
Was sind die Fakten? Die positiven Wirkungen einer Langzeittherapie mit Sexualhormonen auf Haut und Gelenke sind angesichts der spärlichen
Datenlage übertrieben. Diverse Phänomene mögen in experimentellen und Kurzzeit-Studien identifizierbar sein,15,44,65 langfristig sind
klinisch relevante Wirkungen unbewiesen. Andernfalls müßten durch die Veränderungen des äußeren Erscheinungsbildes jene Frauen zu
identifizieren sein, die mit Hormonen behandelt werden, wie dies z.B. bei Rauchern durchaus möglich ist.71 Entsprechende Untersuchungen liegen
bisher nicht vor. Eine Indikation für Östrogene oder Gestagene als Antirheumatika gibt es nicht. Andererseits werden andere unerwünschte
Nebenwirkungen der Hormontherapie häufig bagatellisiert. So ist es für viele Frauen nicht akzeptabel, wieder Blutungen zu bekommen, und ein wichtiges
Argument gegen eine Hormontherapie.6 Die Bindung an den (Frauen)arzt und andere medizinische Institutionen zur "Überwachung" und
Durchführung diagnostischer Kontrollen (z.B. Endometriumbiopsie, Abrasio) ist ein negativer Aspekt dieser medikamentösen Langzeitbehandlung.
Außerdem wird oft übersehen, daß unter der Östrogen-Gestagen-Therapie gerade jene Beschwerden auftreten können, die zu beseitigen
durch eben diese Therapie avisiert wurde, wie depressive Verstimmungen, Kopfschmerzen, Müdigkeit. Selten erwähnt werden andere mögliche
Nebenwirkungen einer Hormontherapie, wie z.B. das auf das 2fache erhöhte Risiko einer Cholezystolithiasis.36,82
Auswirkungen der Hormontherapie auf die Gesamt-Mortalität
Trotz einer hypothetischen Reduktion der kardiovaskulären Morbidität bis zu 50% verlängert sich die Lebenserwartung nicht oder nur
wenig.36,35 Werden kardiovaskuläre Komplikationen vermieden oder hinausgezögert, manifestieren sich in der Zwischenzeit andere
Erkrankungen. Tabelle 2 zeigt die hypothetischen Jahre an Lebensverlängerung durch Hormontherapie in der Postmenopause, wie sie in der Metaanalyse von
Grady u. Ma. errechnet wurden.36 Nochmals muß darauf hingewiesen werden, daß diesen Berechnungen ausschließlich Kohortenstudien
und Fall-Kontroll-Studien zugrunde liegen und aus den bereits erwähnten Gründen die positiven Effekte wahrscheinlich deutlich überbewertet
wurden. Doch selbst diese äußerst optimistische Darstellung zeigt, daß die hypothetischen Effekte auf die Lebenserwartung limitiert sind und es
durchaus verständlich wäre, eine Therapie mit Sexualhormonen unter diesen Gesichtspunkten abzulehnen.79 Tabelle 3 gibt schließlich eine
Gesamtdarstellung möglicher vor- und nachteiliger Effekte einer präventiven Langzeittherapie mit Sexualhormonen in der Postmenopause. Die
Beipackzettel könnten ähnliche Darstellungen des Nutzen-Risiko-Verhältnisses beinhalten.

Differenzierte Betrachtung der Effekte der Langzeittherapie mit Sexualhormonen bei Frauen mit Diabetes mellitus
Am Beispiel des Diabetes mellitus soll verdeutlicht werden, daß zur Zeit eine generelle Verordnung einer präventiven Langzeit-Hormontherapie in der
Postmenopause, insbesondere bei Frauen mit erhöhtem kardiovaskulären Risiko, keinesfalls vetretbar ist. Frauen mit Diabetes mellitus wären zufolge
der deutschen Konsensuspapiere besonders für eine solche Behandlung geeignet, da sie ein hohes kardiovaskuläres Risiko mit
Fettstoffwechselstörungen und Hypertonie aufweisen.
Dem steht entgegen, daß es bisher keine Interventionsstudien bei Patientinnen mit Diabetes mellitus gibt.
Selbst aus Kohortenstudien und Fall-Kontroll-Studien wurden Frauen mit Diabetes mellitus häufig ausgeschlossen. Der Diabetes mellitus war bisher eine
absolute oder relative Kontraindikation für die Behandlung mit Hormonen, vor allem wenn gleichzeitig andere kardiovaskuläre oder thromboembolische
Risikofaktoren oder Erkrankungen vorlagen, wie Herzinfarkt, Hypertonie oder Rauchen.
Typ 1 und Typ 2 Diabetes mellitus – kardiovaskuläre Komplikationen
Frauen mit Diabetes zeigen im Vergleich zu Männern nicht die relative kardiovaskuläre Protektion, wie sie bei jüngeren Frauen ohne Diabetes
gefunden wird.12,80,85 Bei Typ 2 Diabetes sind allerdings bereits vor und bei Diagnose in einem hohen Prozentsatz andere kardiovaskuläre
Risikofaktoren oder kardiovaskuläre Erkrankungen nachweisbar, unabhängig davon, ob der Diabetes prä- oder postmenopausal
auftritt.43,85 Es gibt keinerlei Belege, daß die erhöhte kardiovaskuläre Morbidität und Mortalität bei Typ 2 Diabetes mellitus, und
insbesondere bei Frauen, auf einen Östrogenmangel zurückzuführen sind.2,7,43,78,80,85 Es liegen bisher auch keine Studien vor, die
zeigen, daß die metabolische Stoffwechsellage oder die Hypertonie der Patientinnen mit Diabetes langfristig durch eine Therapie mit Sexualhormonen
günstig zu beeinflussen wären. 2, 32,74,85 Hingegen spricht sehr viel dafür, daß Frauen mit Typ 2 Diabetes bei dem fast immer
gleichzeitig bestehenden Übergewicht eher erhöhte Östrogenspiegel haben.10,53
Bei Typ 1 Diabetes ist der wichtigste prognostische Faktor für die kardiovaskuläre Mortalität die diabetische Nephropathie. Die Prognose der
Nephropathie einschließlich kardiovaskulärer Mortalität hängt neben der Blutglukoseeinstellung entscheidend vom Grad der Hypertoniekontrolle
und vom Raucherstatus der Patientin ab.76,81 Von einer Behandlung mit Sexualhormonen im Stadium der Nephropathie wurde bisher abgeraten, und es
liegen derzeit keinerlei Erkenntnisse darüber vor, daß ein gegenteiliges Vorgehen vertretbar wäre.
Über die möglichen langfristigen Auswirkungen unterschiedlicher Sexualhormonpräparate und Anwendungsformen auf Stoffwechsel und Blutdruck
bei Diabetes ist nichts bekannt. Ein besonders ungünstiger Effekt auf die Triglyzeridwerte wäre denkbar.105
Typ 1 und Typ 2 Diabetes mellitus – Osteoporose
Bei schlechter Blutglukoseeinstellung und mikroangiopathischen Spätschäden wurde bei Patienten mit Typ 1 Diabetes im Vergleich zu Personen ohne
Diabetes eine verminderte Knochendichte gefunden.5,55,68,69 Bei Frauen mit Typ 2 Diabetes wurde in verschiedenen Studien eine um etwa 10%
erhöhte Knochendichte gefunden.10,13,53 Durch das typischerweise bestehende Übergewicht und die ohnehin eher hohe Knochendichte
stellen diese Patientinnen eine Gruppe von Personen dar, die vor Osteoporose relativ geschützt erscheinen. Weder Typ 1 noch Typ 2 Diabetiker haben
häufiger Knochenfrakturen als andere Menschen, sondern eher weniger.45,70 Aus diesem Grund und wegen der meist verkürzten
Lebenserwartung, vor allem bei diabetischen Spätschäden, erscheint eine Hormon-Behandlung von Frauen mit Diabetes zur Vorbeugung osteoporotischer
Knochenfrakturen noch weniger indiziert als bei Frauen ohne Diabetes.
Typ 1 und Typ 2 Diabetes mellitus – Nebenwirkungen
Patientinnen mit Typ 2 Diabetes und Übergewicht leiden häufiger als andere Frauen an Cholezystolithiasis, 42,52,54 und sie haben ein
erhöhtes Risiko für Mammakarzinom und Endometriumkarzinom.16,41,50 Das theoretische Risiko einer Hormontherapie ist daher für diese
Patientinnen besonders ungünstig.
- Aloia, J. F., A. Vaswani, J. K. Yeh, P. L. Ross, E. Flaster, F. A. Dilmanian: Calcium supplementation with and without hormone replacement therapy to prevent
postmenopausal bone loss. Ann. Intern. Med. 120 (1994) 97-103
- American Diabetes Association: Role of cardiovascular risk factors in prevention and treatment of macrovascular disease in diabetes. Diabetes Care 12 (1989)
573-579
- Andersson, B., P. Marin, L. Lissner, A. Vermeulen, P. Björntorp: Testosterone concentrations in women and men with NIDDM. Diabetes Care 17 (1994) 405
-411
- Arzneimittel zum Hormonersatz in den Wechseljahren. BGA ordnet Änderung von Fach- und Gebrauchsinformationen an. Rhein. Ärztebl. 47 (1993)
730
- Auwerx, J., J. Dequeker, R. Bouillon, P. Geusens, J. Nijs: Mineral metabolism and bone mass at peripheral and axial skeleton in diabetes mellitus. Diabetes 37
(1988) 8-12
- Barentsen, R., F. P. M. J. Groeneveld, F. P. Bareman, A. W. Hoes, H. J. Dokter, A. C. Drogendijk: Women's opinion on withdrawal bleeding with hormone
replacement therapy. Europ. J. Obstet. Gynecol. 51 (1993) 203-207
- Barrett-Connor, E., B. A. Cohn, D. L. Wingard, S. L. Edelstein: Why is diabetes mellitus a stronger risk factor for fatal ischemic heart disease in women than in
men? J. Am. Med. Ass. 265 (1991) 627-631
- Barrett-Connor, E., D. L. Winfard, M. H. Crique: Postmenopausal estrogen use and heart disease risk factors in the 1980s. J. Am. Med. Ass. 161 (1989) 2095-
2100
- Barrett-Connor, E., K.-T. Khaw, S. S. C. Yen: Endogenous sex hormone levels in older adult men with diabetes mellitus. Am. J. Epidemiol. 132 (1990) 895-901
- Barrett-Connor, E., T. L. Holbrook: Sex differences in osteoporosis in older adults with non-insulin-dependent diabetes mellitus. J. Am. Med. Ass. 268 (1992) 3333
-3337
- Barrett-Connor, E., W. V. Brown, J. Turner, M. Austin, M. H. Criqui: Heart disease risk factors and hormone use in postmenopausal women. J. Am. Med. Ass. 241
(1979) 2167-2169
- Barrett-Connor, E.: Postmenopausal estrogen and prevention bias. Ann. Int. Med. 115 (1991) 455-456
- Bauer, D. C., W. S. Browner, J. A. Cauley, E. S. Orwoll, J. C. Scott, D. M. Black, J. L. Tao, S. R. Cummings: Factors associated with appendicular bone mass in
older women. Ann. Intern. Med. 118 (1993) 657-665
- Bergkvist, L., H.-O. Adami, I. Persson, R. Hoover, C. Schairer: The risk of breast cancer after estrogen and estrogen-progestin replacement. N. Engl. J. Med. 321
(1989) 293-297
- Brincat, M., E. Versi, C. F. Moniz, A. Magos, J. de Trafford, W. W. Studd: Skin collagen changes in postmenopausal women receiving different regimens of
estrogen therapy. Obstet. Gynecol 70 (1987) 123-127
- Brinton, L. A., R. N. Hoover: Estrogen replacement therapy and endometrial cancer risk: unresolved issues. Obstet. Gynecol. 81 (1993) 265-271
- Bush, T. L., E. Barrett-Connor, L. D. Cowan, M. H. Criqui, R. B. Wallace, C. M. Suchindran, H. A. Tyroler, B. M. Rifkin: Cardiovascular mortality and
noncontraceptive use of estrogen in women: results from the Lipid Research Clinics Program Follow-up Study. Circulation 75 (1987) 1102-1109
- Cauley, J. A., S. R. Cummings, D. M. Black, S. R. Mascioli, D. G. Seeley: Prevalence and determinants of estrogen replacement therapy in elderly women. Am. J.
Obstet. Gynecol. 163 (1990) 1438-1444
- Chapuy, M. C., M. E. Arlot, F. Duboeuf, J. Brun, B. Crouzet, S. Arnaud, P. D. Delmas, P. J. Meunier: Vitamin D3 and calcium to prevent hip fractures in elderly
women. N. Engl. J. Med. 327 (1992) 1637-1642
- Christiansen, C., B. Juel Riis: 17ß-estradiol and continuous norethisterone: a unique treatment for established osteoporosis in elderly women. J. Clin.
Endocrinol. Metab. 71 (1990) 836-841.
- Colditz, G. A., K. M. Egan, M. J. Stampfer: Hormone replacement therapy and risk of breast cancer: results from epidemiological studies. Am. J. Obstet. Gynecol.
168 (1993) 1473-1480
- Coronary Drug Project Research Group. Influence of adherence to treatment and response of cholesterol on mortality in the coronary drug project. N. Engl. J.
Med. 303 (1980) 1038-1041
- Coronary Drug Project Research Group: The Coronary Drug Project. Initial findings leading to modifications of its research protocol. J. Am. Med. Ass. 214 (1970)
1303-1313
- Coronary Drug Project Research Group: The Coronary Drug Project. Findings leading to discontinuation of the 2,5-mg/day estrogen group. J. Am. Med. Ass. 226
(1973) 652-657
- Criqui, M. H., L. Suarez, E. Barrett-Connor, J. McPhillips, D. L. Wingard, C. Garland: Postmenopausal estrogen use and mortality. Results from a prospective study
in a defined, homogenous community. Am. J. Epidemiol. 128 (1988) 606-614
- Dören, M., H. P. G. Schneider: Klimakterium und Menopause. In Hesch, R. D. (Ed.): Endokrinologie, Teil B Krankheitsbilder (Urban & Schwarzenberg:
München-Wien-Baltimore 1989), 1242-1254
- Eaker, E. D., W. P. Castelli: Differential risk for coronary heart disease among women in the Framingham Study. In Eaker, E., B. Packard, N. Wenger, T.
Clarkson, H. A. Tyroler (Eds.): Coronary heart disease in women (Haymarket Doyma: New York 1987), 122-130
- Fahraeus, L., U. Larsson-Cohn, L. Wallentin: L-Norgestrel and progesterone have different influences on plasma lipoproteins. Eur. J. Clin. Invest 13 (1983) 447-
453
- Falkeborn, M., I. Persson, H.-O. Adami, R. Bergström, E. Eaker, H. Lithell, R. Mohsen, T. Naessén: The risk of acute myocardial infarction after
oestrogen and oestrogen-progestogen replacement. Br. J. Obstet. Gynecol. 99 (1992) 821-828
- Felson D. T., Y. Zhang, M. T. Hannan, D. P. Kiel, P. W. F. Wilson, J. J. Anderson: The effect of postmenopausal estrogen therapy on bone density in elderly
women. N. Engl. J. Med. 329 (1993) 1141-1146
- Forrow, L., S. A. Wartman, D. W. Brock: Science, ethics, and the making of clinical decisions. Implications for risk factor intervention. J. Am. Med. Ass. 259
(1988) 3161-3167
- Godsland, I. F., K. Gangar, C. Walton, M. P. Cust, M. I. Whitehead, V. Wynn, J. C. Stevenson: Insulin resistance, secretion, and elimination in postmenopausal
women receiving oral or transdermal hormone replacement therapy. Metabolism 42 (1993) 846-853
- Goldman, L., A. N. A. Tosteson: Uncertainty about postmenopausal estrogen. Time for action, not debate. N. Engl. J. Med. 325 (1991) 800-802
- Gordon, T., W. B. Kannel, M. C. Hjortland: Menopause and coronary heart disease. The Framingham Study. Ann. Intern. Med. 89 (1978) 157-161
- Gorsky, R. D., J. P. Koplan, H. B. Peterson, S. B. Thacker: Relative risks and benefits of long-term estrogen replacement therapy: a decision analysis. Obstet.
Gynecol. 83 (1994) 161-166
- Grady, D., S. M. Rubin, D. B. Petitti, C. S. Fox, D. Black, B. Ettinger, V. L. Ernster, S. R. Cummings: Hormone therapy to prevent disease and prolong life in
postmenopausal women. Ann. Int. Med. 117 (1992) 1016-1037
- Grant, E. C. G.: Long-term dangers of hormonal treatment. Lancet 343 (1994) 926
- Greenspan, S. L., E. R. Myers, L. A. Maitland, N. M. Resnick, W. C. Hayes: Fall severity and bone mineral density as risk factors for hip fracture in ambulatory
elderly. J. Am. Med. Ass. 271 (1994) 128-133
- Grey, A. B., T. F. Cundy, I. R. Reid: Continuous combined oestrogen/progestin therapy is well tolerated and increases bone density at the hip and spine in post-
menopausal osteoporosis. Clin. Endocrinol. 40 (1994) 671-677
- Grisso, J. A., J. L. Kelsey, B. L. Strom, G. Y. Chiu, G. Maislin, L. A. O'Brien, S. Hoffman, F. Kaplan: Risk factors for falls as a cause of hip fracture in women. N.
Engl. J. Med. 324 (1991) 1326-1331
- Grönroos, M., T. A. Salmi, M. H. Vuento, E. A. Jalava, J. E. Tyrkkö, J. I. Maatela, A. R. Aromaa, R. Siegberg, E. R. Savolainen, T. V. Kauraniemi: Mass
screening for endometrial cancer directed in risk groups of patients with diabetes and patients with hypertension. Cancer 71 (1993) 1279-1282
- Haffner, S. M., A. K. Diehl, B. D. Mitchell, M. P. Stern, H. P. Hazuda: Increased prevalence of clinical gallbladder disease in subjects with non-insulin-dependent
diabetes mellitus. Am. J. Epidemiol. 132 (1990) 327-335
- Haffner, S. M., M. P. Stern, H. P. Hazuda, B. D. Mitchell, J. K. Patterson: Cardiovascular risk factors in confirmed prediabetic individuals. J. Am. M. Ass. 263
(1990) 2893-2898
- Hassager, C., C. Christiansen: Estrogen/gestagen therapy changes soft tissue body composition in postmenopausal women. Metabolism 38 (1989) 662-665
- Heath, H., L. J. Melton, C. P. Chu: Diabetes mellitus and risk of skeletal fracture. N. Engl. J. Med. 303 (1980) 567-570
- Hehrmann, R.: Rational und rationell – zur Diagnostik der Osteoporose. Münch. Med. Wschr. 135 (1993) 639-640
- Hemminki, E., D. L. Kennedy, C. Baum, S. M. McKinlay: Prescribing of noncontraceptive estrogens and progestins in the United States, 1974-86. Am. J. Public
Health 78 (1988) 1478-1481
48 - Henrich, J. B.: The postmenopausal estrogen/breast cancer controversy. J. Am. Med. Ass. 268 (1992) 1900-1902
- Hirvonen, E., M. Mälkönen, V. Manninen: Effects of different progestogens on lipoproteins during postmenopausal replacement therapy. N. Engl. J.
Med. 304 (1981) 560-563.
50 - Hoogerland, D. L., D. A. Buchler, J. J. Crowley, W. F. Carr: Estrogen use – risk of endometrial carcinoma. Gynecol. Oncol. 6 (1978) 451-458
- Horwitz, R. I., C. M. Viscoli, L. Berkman, R. M. Donaldson, S. M. Horwitz, C. J. Murray, D. F. Ransohoff, J. Sindelar: Treatment adherence and risk of death after
a myocardial infarction. Lancet 336 (1990) 542-545
- Ikard, R. W.: Gallstones, cholecystitis and diabetes. Surgery, Gynecol. & Obstet. 171 (1990) 528-532
- Johnston, C. C., S. L. Hui, C. Longcope: Bone mass and sex steroid concentrations in postmenopausal caucasian diabetics. Metabolism 34 (1985) 544-550
- Jorgensen, T.: Gall stones in a danish population. Relation to weight, physical activity, smoking, coffee consumption, and diabetes mellitus. Gut 30 (1989) 528-
534
- Kayath, M. J., S. A. Dib, J. G. H. Vieira: Prevalence and magnitude of osteopenia associated with insulin-dependent diabetes mellitus. J. Diab. Comp. 8 (1994) 97
-104
- Kiel, D. P., J. A. Baron, J. J. Anderson, M. T. Hannan, D. T. Felson: Smoking eliminates the protective effect of oral estrogens on the risk for hip fracture among
women. Ann. Int. Med. 116 (1992) 716-721
- Kuczmarski, R. J., K. M. Flegal, S. M. Campbell, C. L. Johnson: Increasing prevalence of overweight among US adults. J. Am. Med. Ass. 272 (1994) 205-211
- Kuhl, H.: Substitution mit Östrogenen und Gestagenen. 11. Arbeitstreffen des "Zürcher Gesprächskreises". Dtsch. Ärztebl. 91
(1994), B 571-573
- Kuhl, H.: Substitution mit Östrogenen und Gestagenen. 9. Arbeitstreffen des "Zürcher Gesprächskreises". Dtsch. Ärztebl. 90
(1993), B 1674-1675
- Lange, S.: Sensitivität, Spezifität und prädiktive Werte der Knochendichtemessung bei der Osteoporose. Dissertation, Medizinische Fakultät
der Heinrich-Heine-Universität Düsseldorf, 1994
- Lauritzen J. B., M. M. Petersen, B. Lund: Effect of external hip protectors on hip fractures. Lancet 341 (1993) 11-13
- Lauritzen, C.: Hormonsubstitution in der Menopause. Konsensus der Menopausegesellschaft deutschsprachiger Länder. Dtsch. Ärztebl. 90 (1993), B
694-696
- Law, M. R., N. J. Wald, T. W. Meade: Strategies for prevention of osteoporosis and hip fracture. Br. Med. J. 303 (1991) 453-459
- Lindsay, R., D. M. Hart, A. MacLean, A. C. Clark, A. Kraszewski, J. Garwood: Bone response to termination of oestrogen treatment. Lancet i (1978) 1325-
1327
- Maheux, R., F. N. Naud, M. Rioux, R. Grenier, A. Lemay, J. Guy, M. Langevin: A randomized, double-blind, placebo-controlled study on the effect of conjugated
estrogens on skin thickness. Am. J. Obstet. Gynecol. 170 (1994) 642-649
- Manolio, T. A., C. D. Furberg, L. Shemanski, B. M. Psaty, D. H. O'Leary, R. P. Tracy, T. L. Bush: Association of postmenopausal estrogen use with
cardiovascular disease and its risk factors in older women. Circulation 88 (1993) 2163-2171
- Marshall, E.: Search for a killer: focus shifts from fat to hormones. Science 259 (1993) 618-621
- Mathiassen, B., S. Nielsen, J. S. Johansen, D. Hartwell, J. Ditzel, P. Rodbro, C. Christiansen: Long-term bone loss in insulin-dependent diabetic patients with
microvascular complications. J. Diab. Complications 4 (1990) 145-149
- McNair, P.: Bone mineral metabolism in human type 1 (insulin-dependent) diabetes mellitus. Dan. Med. Bull. 35 (1988) 109-121
- Melchior, T. M., H. Sorensen, C. Torp-Pedersen: Hip and distal arm fracture rates in peri- and postmenopausal insulin-treated diabetic females. J. Int. Med. 236
(1994) 203-208
71 - Model, D.: Smoker's face: an underrated clinical sign? Br. Med. J. 291 (1985) 1755, 1760-1762
- Morrison, N. A., J. C. Qi, A. Tokita, P. J. Kelly, L. Crofts, T. V. Nguyen, P. N. Sambrook, J. A. Eisman: Prediction of bone density from vitamin D receptor alleles.
Nature 367 (1994), 284-287
- Morrison, N. A., R. Yeoman, P. J. Kelly, J. A. Eisman: Contribution of trans-acting factor alleles to normal physiological variability: Vitamin D receptor gene
polymorphisms and circulating asteocalcin. Proc. Natl. Acad. Sci. 89 (1992) 6665-6669
- Mosnier-Pudar, H., B. Faguer, T. T. Guyenne, G. Tchobroutsky: Effets de la substitution par 17 ß estradiol percutané et progestérone orale
sur la pression artérielle et les paramEtres métaboliques chez des patientes ménopausées diabétiques non
insulinodépendantes. Arch. Mal. Coeur 84 (1991) 1111-1115
- Mott, S.: Bone mass measurements: reasons to be cautious. Br. Med. J. 308 (1994) 931-932
- Mühlhauser, I.: Cigarette smoking and diabetes: an update. Diabetic Med. 11 (1994) 336-343
- Nabulsi, A. A., A. R. Folsom, A. White, W. Patsch, G. Heiss, K. K. Wu, M. Szklo: Association of hormone-replacement therapy with various cardiovascular risk
factors in postmenopausal women. N. Engl. J. Med. 328 (1993) 1069-1075
- Nyholm, H., H. Djursing, C. Hagen, T. Anger, P. Bennett, B. Svenstrup: Androgens and estrogens in postmenopausal insulin-treated diabetic women. J. Clin.
Endocrinol. Metab. 69 (1989) 946-949
- Olshansky, S. J., B. A. Carnes, C. Cassel: In search of Methuselah: estimating the upper limits of human longevity. Science 250 (1990) 634-640
- Panzram, G.: Mortality and survival in Type 2 (non-insulin-dependent) diabetes mellitus. Diabetologia 30 (1987) 123-131
- Parving, H.-H., E. Hommel: Prognosis in diabetic nephropathy. Br. Med. J. 299 (1989) 336-343
- Petitti, D. B., S. Sidney, J. A. Perlman: Increased risk of cholecystectomy in users of supplemental estrogen. Gastroenterol. 94 (1988) 91-95
- Posthuma, W. F. M., R. G. J. Westendorp, J. P. Vandenbroucke: Cardioprotective effect of hormone replacement therapy in postmenopausal women: is the
evidence biased? Br. Med. J. 308 (1994) 1268-1269
- Psaty, B. M., S. R. Heckbert, D. Atkins, R. Lemaitre, T. D. Koepsell, P. W. Wahl, D. S. Siscovick, E. H. Wagner: The risk of myocardial infarction associated with
the combined use of estrogens and progestins in postmenopausal women. Arch. Intern, Med. 154 (1994) 1333-1339
- Pyörälä, K., M. Laakso, M. Uusitupa: Diabetes and atherosclerosis: an epidemiological view. Diabetes Metab. Rev. 3 (1987) 463-534
- Reid, I. R., R. W. Ames, M. C. Evans, G. D. Gamble, S. J. Sharpe: Effect of calcium supplementation on bone loss in postmenopausal women. N. Engl. J. Med.
328 (1993) 460-464
- Ringe, J. D., F. Meiss: Vermeidung früh-postmenopausischer Knochensubstanzverluste durch transdermale Östrogensubstitution. Dtsch. Med. Wschr.
118 (1993) 769-774
- Rosenberg, L., J. R. Palmer, S. Shapiro: A case-control study of myocardial infarction in relation to use of estrogen supplements. Am. J. Epidemiol. 137 (1993) 54
-63
- Rosenberg, L.: Hormone replacement therapy: the need for reconsideration. Am. J. Public Health 83 (1993) 1670-1673
- Ross, R. K., A. Paganini-Hill, S. Roy, A. Chao, B. E. Henderson: Past and present preferred prescribing of hormone replacement therapy among Los Angeles
Gynecologists: Possible implications for public health. Am. J. Public Health 78 (1988) 516-519
- Sackett, D. L., R. B. Haynes, G. H. Guyatt, P. Tugwell: Clinical epidemiology. A basic science for clinical medicine. 2nd ed. (Little, Brown and Company: Boston-
Toronto-London 1991) 187-248
- Schapira, D. V., N. B. Kumar, G. H. Lyman, C. E. Cox: Abdominal obesity and breast cancer risk. Ann. Intern. Med. 112 (1990) 182-186
- Schwabe, U., R. Rabe: Sexualhormone. In Schwabe, U., D. Paffrath (Eds.) Arzneiverordnungs-Report '93 (Gustav Fischer Verlag: Stuttgart-Jena 1993) 377-
387
- Skrabanek, P., J. McCormick: Follies and fallacies in medicine. 2nd ed. (Tarragon Press: Glasgow 1992)
- Skrabanek, P.: Nonsensus consensus. Lancet i (1990) 1446-1447
- Skrabanek, P.: The physician's responsibility to the patient. Lancet i (1988) 1155-1156
- Spiro, H. M.: Doctors, patients, and placebos. (Yale University Press: New Haven-London 1986)
- Stampfer, M. J., G. A. Colditz, W. C. Willett, J. E. Manson, B. Rosner, F. E. Speizer, C. H. Hennekens: Postmenopausal estrogen therapy and cardiovascular
disease. Ten-year follow-up from the Nurses' Health Study. N. Engl. J. Med. 325 (1991) 756-762
- Steel, J. M.: Hormone replacement therapy and diabetes. Short-term therapy for climacteric/menopausal symptoms. Diab. Gen. Pract. 4 (1994) 11-12
- Steinberg, K. K., S. B. Thacker, S. J. Smith, D. F. Stroup, M. M. Zack, W. D. Flanders, R. L. Berkelman: A meta-analysis of the effect of estrogen replacement
therapy on the risk of breast cancer. J. Am. Med. Ass. 265 (1990) 1985-1990
- Sullivan, J. M., R. V. Zwaag, J. P. Hughes, V. Maddock, F. W. Kroetz, K. B. Ramanathan, D. M. Mirvis: Estrogen replacement and coronary artery disease. Effect
on survival in postmenopausal women. Arch. Intern. Med. 150 (1990) 2557-2562
- TeVelde, E. R., H. A. I. M. van Leusden: Hormonal treatment for the climacteric: alleviation of symptoms and prevention of postmenopausal disease. Lancet 343
(1994) 654-658
- Vandenbroucke, J. P.: Postmenopausal oestrogen and cardioprotection. Lancet 337 (1991) 833-834
- Voigt, L. F., N. S. Weiss, J. Chu, J. R. Daling, B. McKnight, G. vanBelle: Progestagen supplementation of exogenous oestrogens and risk of endometrial cancer.
Lancet 338 (1991) 274-277
- Walsh, B. W., I. Schiff, B. Rosner, L. Greenberg, V. Ravnikar, F. M. Sacks: Effects of postmenopausal estrogen replacement on the concentrations and
metabolism of plasma lipoproteins. N. Engl. J. Med. 325 (1991) 1196-1204
- Wenderlein, J. M.: Lipid-Stoffwechselveränderungen und die Folgen bei postmenopausalen Frauen. Dtsch. Ärztebl. 91 (1994), B 740-742
- Wilson, P. W. F., R. J. Garrison, W. P. Castelli: Postmenopausal estrogen use and heart disease. N. Engl. J. Med. 315 (1986) 135
- Wilson, P. W. F., R. J. Garrison, W. P. Castelli: Postmenopausal estrogen use, cigarette smoking, and cardiovascular morbidity in women over 50. N. Engl. J.
Med. 313 (1985) 1038-1043
- Wolf, P. H., J. H. Madans, F. F. Finucane, M. Higgins, J. C. Kleinman: Reduction of cardiovascular disease-related mortality among postmenopausal women who
use hormones: evidence from a national cohort. Am. J. Obstet. Gynecol 164 (1991) 489-499
|



