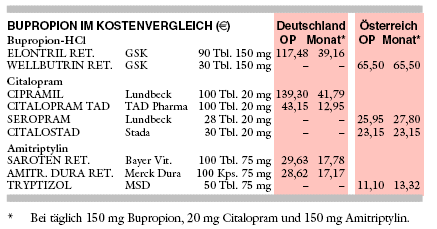
BUPROPION |
In den USA werden Amphetamine - trotz unbefriedigender Datenlage - traditionell off label auch zur Behandlung depressiver Patienten verwendet. Das
dort seit 20 Jahren als Antidepressivum zugelassene amphetaminartige Bupropion (WELLBUTRIN) diente hierzulande bislang nur als
Raucherentwöhnungsmittel (ZYBAN, a-t 2000; 31: 59-60). Seit April 2007 ist es unter der Bezeichnung EIGENSCHAFTEN: Der genaue Wirkmechanismus ist unbekannt. Bupropion ist ein schwacher Noradrenalin- und Dopamin-
Wiederaufnahmehemmer.1 In klinisch relevanten Dosierungen blockiert es nur 22% bis 26% der Bindungsstellen des Dopamintransporters.2 In
Deutschland ist das Antidepressivum in retardierter Zubereitung (XL) für die einmal tägliche Einnahme von 150 mg oder 300 mg zugelassen. In einer
Studie3 mit der als bioäquivalent eingestuften zweimal täglich anzuwendenden SR-Zubereitung schneiden beide Dosierungen gleich ab. Eine
optimale Dosis lässt sich in Studien nicht ermitteln.4 KLINISCHE WIRKSAMKEIT: Lediglich eine 52-wöchige zulassungsrelevante Studie5,6 gegen Plazebo ist veröffentlicht. Nur
Teilnehmer, die auf acht Wochen offen eingenommenes Bupropion angesprochen haben, werden anschließend zweimal täglich 150 mg Bupropion SR,
einer hierzulande nicht zugelassenen Retardform, oder Plazebo randomisiert zugeteilt. Gerade einmal 12% (103 von 828) beenden die Studie. Für Plazebo wird
eine Rückfallrate von 52% errechnet, unter Bupropion von 37%.5,6 Da nur Bupropion-Responder eingeschlossen werden, das Absetzdesign
Plazeboanwender benachteiligt und zudem ungefähr ein Drittel der Teilnehmer unter Plazebo (32%) und Bupropion (36%) "verloren gehen", ihr
Einverständnis widerrufen etc. und offenbar nicht nachbeobachtet werden,7 ist das Ergebnis nicht aussagefähig.
Von drei weiteren zulassungsrelevanten Studien8,9, die jedoch nicht publiziert sind, fallen zwei im prädefinierten primären Endpunkt negativ aus.
Dies entspricht der für Antidepressiva üblichen Situation: Um genügend Positivstudien für die Zulassung zu erhalten, muss ein Mehrfaches an
Studien durchgeführt werden (a-t 2005; 36: 45-6).
|
| (R= randomisierte Studie) | |
|
1 |
GSK: US-amerikanische Produktinformationen WELLBUTRIN/-XL, Stand Juni 2006 und Sept. 2006 |
|
2 |
DUNLOP, B.W., NEMEROFF, C.B.: Arch. Gen. Psychiatry 2007; 64: 327-37 |
R |
3 |
REIMHERR, F.W. et al.: Clin. Ther. 1998; 20: 505-16 |
|
4 |
GSK: Fachinformation ELONTRIL, Stand Feb. 2007 |
|
5 |
WEIHS, K.L. et al.: Biol. Psychiatry 2002; 51: 753-61 |
|
6 |
GSK Datenbank, Studie mit Nummer WELL AK1A4004 http://ctr.gsk.co.uk/Summary/bupropion/studylist.asp |
|
7 |
FDA/CDER: Medical Review Bupropion, Stand März 2001, |
|
8 |
GSK Datenbank, Studien mit den Nummern WXL 101497, AK 130939, AK 130 940, siehe Lit. 6 |
|
9 |
GSK: Schreiben vom 16. April 2007 |
R |
10 |
COLEMAN, C.C. et al.: Ann. Clin. Psychiatry 1999; 11: 205-15 |
R |
11 |
CROFT, H. et al.: Clin. Therapeutics 1999; 21: 643-58 |
R |
12 |
COLEMAN, C.C. et al.: Clin. Therapeutics 2001; 23: 1040-58 |
R |
13 |
SEGRAVES, R.T. et al.: J. Clin. Psychopharmacol. 2000; 20: 122-8 |
R |
14 |
CLAYTON A.H. et al.: J. Clin. Psychiatry 2006; 67: 736-46 |
|
15 |
KENNEDY, S.H. et al.: Can. J. Psychiatry 2006; 52: 234-42 |
R |
16 |
DUNNER, D.L. et al.: J. Clin. Psychiatry 1998; 59: 366-73 |
R |
17 |
GSK Datenbank, suicidality analyses, siehe Lit. 6 |
| © 2007 arznei-telegramm |
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
