Als der Impfstoff gegen humane Papillomviren (HPV)  GARDASIL 2006 auf
den Markt kam, lagen die beiden entscheidenden Phase-III-Studien FUTURE* I und II nicht vollständig veröffentlicht vor und waren noch nicht
einmal abgeschlossen (a-t 2006; 37: 117-9). Trotz unzureichender Datenlage beispielsweise hinsichtlich des klinischen
Nutzens bei der Zielgruppe - Mädchen und junge Frauen, die noch keine sexuellen Kontakte hatten - sowie fehlender Langzeitdaten wurde die Vakzine in
vielen Ländern rasch in nationale Impfprogramme aufgenommen. So gab die STIKO hierzulande ihre Empfehlung der generellen HPV-Impfung für
Mädchen zwischen 12 und 17 Jahren "aufgrund des großen öffentlichen Interesses ... ausnahmsweise vorab" bekannt und nicht, wie
sonst üblich, zum regulären Termin im Juli 2007.1 Andernfalls wäre es uns vielleicht wie den Niederländern ergangen: Dort soll eine
Entscheidung erst Ende des Jahres fallen. Doch der europäische GARDASIL-Vertreiber Sanofi Pasteur MSD übt mit einer gigantischen Werbekampagne
über die Gefahren humaner Papillomviren ("schütze deine Tochter") in Radio und anderen Medien Druck auf niederländische Ärzte
aus2 und gibt einen Vorgeschmack auf das, was uns bevorsteht, falls die direkte Werbung bei Verbrauchern erlaubt werden sollte (vgl. Seite 55).** In den USA hat Merck & Co. durch massive Lobbyarbeit erreicht, dass in vielen Staaten die Impfung aller Mädchen
bereits als Voraussetzung für den Schulbesuch gefordert wird.4 GARDASIL 2006 auf
den Markt kam, lagen die beiden entscheidenden Phase-III-Studien FUTURE* I und II nicht vollständig veröffentlicht vor und waren noch nicht
einmal abgeschlossen (a-t 2006; 37: 117-9). Trotz unzureichender Datenlage beispielsweise hinsichtlich des klinischen
Nutzens bei der Zielgruppe - Mädchen und junge Frauen, die noch keine sexuellen Kontakte hatten - sowie fehlender Langzeitdaten wurde die Vakzine in
vielen Ländern rasch in nationale Impfprogramme aufgenommen. So gab die STIKO hierzulande ihre Empfehlung der generellen HPV-Impfung für
Mädchen zwischen 12 und 17 Jahren "aufgrund des großen öffentlichen Interesses ... ausnahmsweise vorab" bekannt und nicht, wie
sonst üblich, zum regulären Termin im Juli 2007.1 Andernfalls wäre es uns vielleicht wie den Niederländern ergangen: Dort soll eine
Entscheidung erst Ende des Jahres fallen. Doch der europäische GARDASIL-Vertreiber Sanofi Pasteur MSD übt mit einer gigantischen Werbekampagne
über die Gefahren humaner Papillomviren ("schütze deine Tochter") in Radio und anderen Medien Druck auf niederländische Ärzte
aus2 und gibt einen Vorgeschmack auf das, was uns bevorsteht, falls die direkte Werbung bei Verbrauchern erlaubt werden sollte (vgl. Seite 55).** In den USA hat Merck & Co. durch massive Lobbyarbeit erreicht, dass in vielen Staaten die Impfung aller Mädchen
bereits als Voraussetzung für den Schulbesuch gefordert wird.4
* |
FUTURE = Females United to Unilaterally Reduce Endo/Ectocervical Disease
|
** |
Die Marketingaktivitäten tragen bereits Früchte: Nach Aussagen der Firma übersteigen die Verkaufszahlen von
GARDASIL in Europa alle Erwartungen. Besonders stark ist der Umsatz in den Ländern, in denen der Impfstoff rasch von nationalen Behörden empfohlen
wurde, nämlich in Deutschland, Österreich und Schweden.3
|
Die jetzt erstmals vollständig vorliegenden Zwischenergebnisse aus FUTURE I und II5,6 lassen jedoch Ernüchterung hinsichtlich des Nutzens der
Vakzine aufkommen und werden nicht nur von einem begleitenden Editorial als "bescheiden" eingestuft.7-9 Zwar bestätigen die
Auswertungen, dass GARDASIL Frauen zwischen 16 und 26 Jahren, die bis einen Monat nach Abschluss der Grundimmunisierung nicht mit einem im Impfstoff
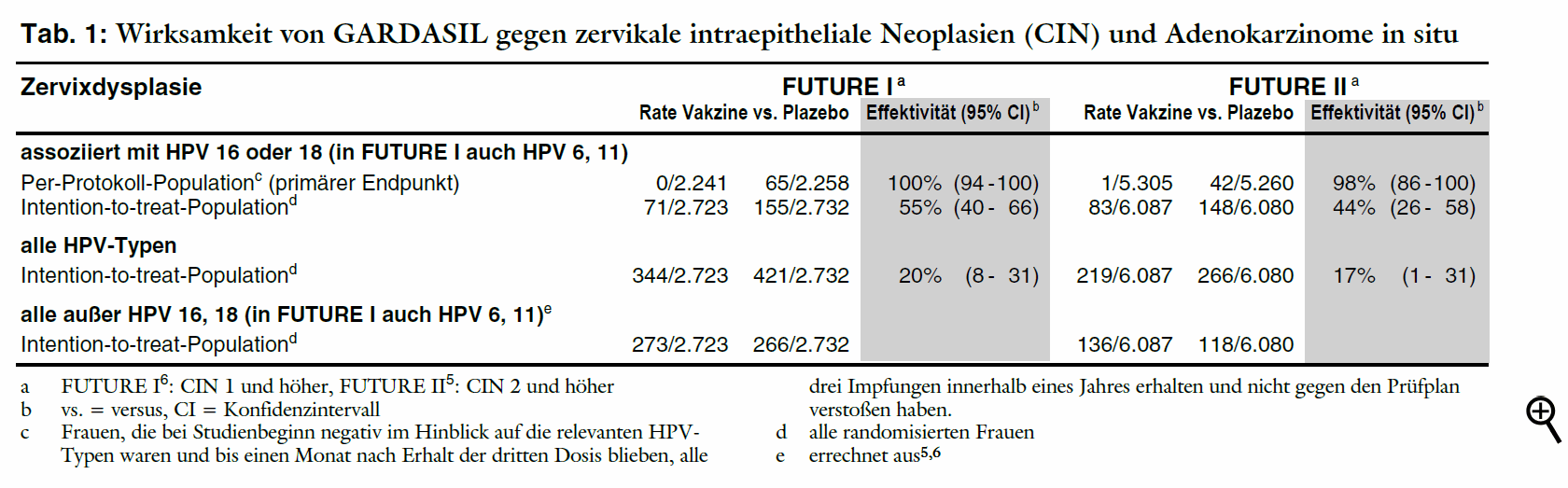
enthaltenen HPV-Typ infiziert sind (Per-Protokoll-Population), innerhalb eines mittleren Beobachtungszeitraums von drei Jahren bis zu 100% vor dysplastischen
Veränderungen aller Schweregrade an Zervix, Vulva und Vagina sowie vor Genitalwarzen durch eben diesen HPV-Typ schützt (primärer
Endpunkt, siehe Tabellen 1 und 2). Auch zeigt sich erneut, dass die Impfung den natürlichen Verlauf einer bereits bestehenden Infektion oder Dysplasie
assoziiert mit HPV 6, 11, 16 oder 18 nicht beeinflusst, also keinen frühen therapeutischen Effekt hat.5,6 Überraschend gering fällt der
Nutzen von GARDASIL jedoch bei Betrachtung der Gesamtzahl der Zervixdysplasien, also unabhängig vom HPV-Typ, in der Gesamtgruppe
der Frauen aus. Obwohl HPV 16 und 18 für 70% der höhergradigen Zervixdysplasien verantwortlich sein sollen,10 kommen diese Veränderungen
unter der Vakzine insgesamt nur 17% seltener vor als unter Plazebo (siehe Tabelle 1).5 Werden nur hochgradige Muttermunddysplasien (mindestens CIN***
3) ausgewertet, die die geringste Wahrscheinlichkeit der Rückbildung haben und sich daher besser als Surrogatparameter für ein Zervixkarzinom eignen -
CIN 2-Dysplasien bilden sich bei bis zu 40% zurück und werden in Leitlinien zum Teil als nicht unmittelbar therapiebedürftig eingestuft7 -,
lässt sich weder in FUTURE II noch bei gemeinsamer Auswertung von vier Phase-2- und 3-Studien11 mit mehr als 20.000 Frauen ein Nutzen der
HPV-Vakzine statistisch sichern.
*** |
CIN = Zervikale intraepitheliale Neoplasie; 1 leichte, 2 mäßiggradige, 3 hochgradige Dysplasie oder
Carcinoma in situ.
|
Dass der Einfluss von GARDASIL auf die Gesamtrate der Zervixdysplasien in der Gesamtgruppe so bescheiden ausfällt, könnte mehrere Gründe
haben: Zum einen kann die Impfung ein Fortschreiten bereits vorhandener Infektionen oder Erkrankungen nicht verhindern. Das Risiko einer HPV-Infektion steigt mit
der Anzahl der Sexualpartner. In FUTURE II waren etwa 20% der Teilnehmerinnen zu Studienbeginn mit HPV 16 und/oder 18 infiziert. 93% hatten schon einmal
Geschlechtsverkehr, wobei mindestens die Hälfte nur einen oder zwei verschiedene Sexualpartner hatten. Frauen mit mehr als vier verschiedenen Partnern
durften nicht teilnehmen.
Zum anderen wurde ein beträchtlicher Teil der Dysplasien in der Plazebogruppe durch nicht im Impfstoff enthaltene HPV-Typen verursacht,7 in
FUTURE II beispielsweise 44%. Dazu passt das Ergebnis einer kürzlich publizierten US-amerikanischen Stichprobe an 2.000 Frauen zwischen 14 und 59
Jahren, in der die Prävalenz von HPV 16 und 18 wesentlich niedriger war als bisher angenommen.12 Zudem gibt es Hinweise auf ein mögliches
Replacement: In beiden FUTURE-Studien und zwei Metaanalysen11,13 ist die Zahl der Läsionen, in denen andere als die in GARDASIL enthaltenen
HPV-Typen nachgewiesen werden, bei Geimpften konsistent numerisch höher als in den Plazebogruppen.
Wie sich die HPV-Impfung über einen längeren Zeitraum als bisher untersucht auf die Gesamtzahl der höhergradigen Zervixdysplasien auswirkt, ob
also der Effekt von GARDASIL mit der Zeit zunimmt oder abnimmt, weil entweder der Schutz nachlässt oder tatsächlich ein relevantes Replacement
auftritt, wird in kontrollierten Studien nicht mehr zu klären sein, da schon vor Monaten damit begonnen wurde, die Plazebogruppen der FUTURE-Studien
ebenfalls zu impfen.14 Für die Per-Protokoll-Populationen, die die Zielgruppe - junge Frauen, die noch keinen Geschlechtsverkehr hatten - am ehesten
repräsentieren, fehlen in beiden Publikationen und den Metaanalysen die entscheidenden Angaben zur Rate der Zervixdysplasien insgesamt, also durch alle
HPV-Typen, obwohl diese Daten bekannt sein müssten. Ohne sie lässt sich aber letztlich weder der tatsächliche Nutzen der Impfung noch die Rolle
anderer onkogener HPV-Typen zuverlässig bewerten.7
Hinsichtlich der Verträglichkeit von GARDASIL ergeben sich aus den FUTURE-Studien keine wesentlichen neuen Erkenntnisse. Mit Lokalreaktionen,
besonders Schmerz, aber auch Rötung, Schwellung und Juckreiz, ist bei mehr als 80% zu rechnen, mit Fieber bei etwa 14%.5,6 In FUTURE II werden
saisonale Allergien unter der Vakzine häufiger diagnostiziert als unter Plazebo (2,2% vs. 0,4%).5 Bei 10- bis 15-jährigen Mädchen und
Jungen kommt es im direkten Vergleich signifikant häufiger zu Fieber als bei 16- bis 23-jährigen Frauen, während lokale Rötungen und
Schmerzen deutlich seltener auftreten.15
Für Aufregung sorgten in den letzten Wochen die von einer Verbraucherschutzorganisation ins Netz gestellten in den USA bislang dokumentierten 1.637
Spontanberichte über mögliche unerwünschte Wirkungen, darunter 371 schwerwiegende Ereignisse wie Krampfanfall, Guillain-Barré-Syndrom
und Fazialislähmung sowie drei Todesfälle. Nach Angaben der Centers of Disease Control and Prevention (CDC) sollen zwei junge Frauen an
thromboembolischen Ereignissen verstorben sein, die auch durch die von beiden Frauen gleichzeitig eingenommenen oralen Kontrazeptiva ausgelöst worden
sein könnten. Ein Mädchen starb demnach an einer bereits vor der Impfung bekannten Myokarditis.16 Aus Australien kommen Berichte über
Übelkeit, Schwindel, Ohnmacht und vorübergehende Lähmungserscheinungen, die von Ärzten und Behörden als Reaktion auf die
Impfung an sich interpretiert und nicht auf den Impfstoff zurückgeführt werden.17,18

 Nach den jetzt endlich vollständig veröffentlichten
Zwischenergebnissen der FUTURE-Studien senkt die HPV-Vakzine Nach den jetzt endlich vollständig veröffentlichten
Zwischenergebnissen der FUTURE-Studien senkt die HPV-Vakzine  GARDASIL die
Gesamtzahl höhergradiger Zervixdysplasien (CIN 2 und höher) bei Frauen zwischen 16 und 26 Jahren, die mehrheitlich bereits sexuelle Kontakte hatten,
nur um 17% und damit deutlich weniger als erhofft. Für die als Surrogatparameter für ein Zervixkarzinom geeigneteren hochgradigen Dysplasien (CIN 3)
lässt sich statistisch kein Effekt sichern. GARDASIL die
Gesamtzahl höhergradiger Zervixdysplasien (CIN 2 und höher) bei Frauen zwischen 16 und 26 Jahren, die mehrheitlich bereits sexuelle Kontakte hatten,
nur um 17% und damit deutlich weniger als erhofft. Für die als Surrogatparameter für ein Zervixkarzinom geeigneteren hochgradigen Dysplasien (CIN 3)
lässt sich statistisch kein Effekt sichern.
 Zervixdysplasien wurden in beiden Studien deutlich seltener als erwartet durch
die im Impfstoff enthaltenen HPV-Typen verursacht. Zervixdysplasien wurden in beiden Studien deutlich seltener als erwartet durch
die im Impfstoff enthaltenen HPV-Typen verursacht.
 Jungen Frauen bietet die Vakzine während der durchschnittlich
dreijährigen Beobachtungszeit (fast) vollständigen Schutz vor Dysplasien aller Schweregrade an Gebärmutterhals, Vulva und Vagina sowie vor
Genitalwarzen durch die im Impfstoff enthaltenen HPV-Typen, sofern sie bis zum Abschluss der Grundimmunisierung nicht mit den entsprechenden Typen infiziert
waren. Jungen Frauen bietet die Vakzine während der durchschnittlich
dreijährigen Beobachtungszeit (fast) vollständigen Schutz vor Dysplasien aller Schweregrade an Gebärmutterhals, Vulva und Vagina sowie vor
Genitalwarzen durch die im Impfstoff enthaltenen HPV-Typen, sofern sie bis zum Abschluss der Grundimmunisierung nicht mit den entsprechenden Typen infiziert
waren.
 Die entscheidende Frage, wie sich GARDASIL in dieser Population (Per-
Protokoll-Population), die am ehesten der Zielgruppe entspricht, nämlich junge Frauen vor dem ersten Geschlechtsverkehr, auf die Gesamtzahl
höhergradiger Zervixdysplasien auswirkt, wird jedoch nicht beantwortet, obwohl die Daten bekannt sein müssten. Die entscheidende Frage, wie sich GARDASIL in dieser Population (Per-
Protokoll-Population), die am ehesten der Zielgruppe entspricht, nämlich junge Frauen vor dem ersten Geschlechtsverkehr, auf die Gesamtzahl
höhergradiger Zervixdysplasien auswirkt, wird jedoch nicht beantwortet, obwohl die Daten bekannt sein müssten.
 Auf dieser Datenbasis ist es unmöglich, den Nutzen der Impfung und die
Rolle anderer onkogener HPV-Typen abzuschätzen. Autoren, Hersteller und Behörden sind dringend gefordert, die Ergebnisse zur Gesamtzahl
höhergradiger Zervixdysplasien in der Per-Protokoll-Population offenzulegen. Ohne diese Daten lässt sich eine Empfehlung von GARDASIL u.E. nicht
begründen. Auf dieser Datenbasis ist es unmöglich, den Nutzen der Impfung und die
Rolle anderer onkogener HPV-Typen abzuschätzen. Autoren, Hersteller und Behörden sind dringend gefordert, die Ergebnisse zur Gesamtzahl
höhergradiger Zervixdysplasien in der Per-Protokoll-Population offenzulegen. Ohne diese Daten lässt sich eine Empfehlung von GARDASIL u.E. nicht
begründen.
|


