KONTROVERS: THERAPIE DER FEUCHTEN MAKULADEGENERATION
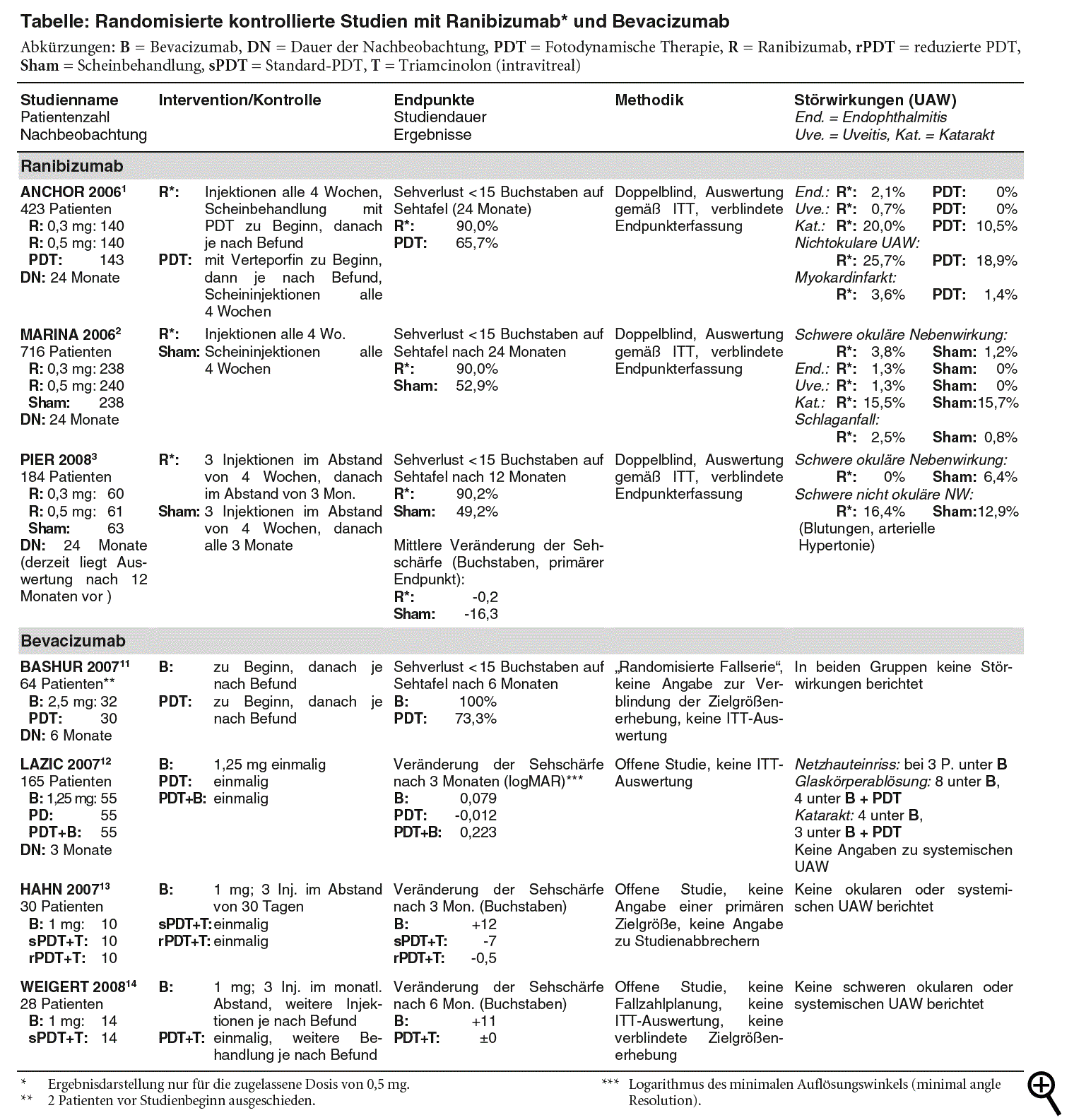
Der Hemmstoff des vaskulären endothelialen Wachstumsfaktors (VEGF) Ranibizumab (LUCENTIS) ist seit Anfang 2007 zur Behandlung der feuchten altersbedingten Makuladegeneration (AMD) zugelassen. Monatliche intravitreale Injektionen über 24 Monate erhalten in den Zulassungsstudien ANCHOR* und MARINA*1,2 die Sehschärfe besser als fotodynamische Therapie (PDT) oder Scheininjektionen (Verlust von weniger als 15 Buchstaben auf einer Sehtafel unter 0,5 mg Ranibizumab 90% versus 66% unter PDT und 53% unter Scheininjektionen; siehe Tabelle). Bei jedem dritten bis vierten Behandelten verbessert sich der Visus (Kontrollen: 5%; a-t 2007; 38: 19-22). Nach Daten der PIER*-Studie, in der nach drei Monaten die Behandlungsintervalle auf vierteljährliche Injektionen verlängert wurden, verschlechtert sich jedoch der anfänglich verbesserte Visus bei Streckung der Abstände und erreicht nach einem Jahr wieder die Ausgangswerte.3
| * | ANCHOR = Anti-VEGF Antibody for the Treatment of Predominantly Classic Choroidal Neovascularization in Age-Related Macular Degeneration, MARINA = Minimal Classic/Occult Trial of the Anti-VEGF Antibody Ranibizumab in the treatment of Neovascular Age Related Macular Degeneration, PIER = Keine Erläuterung des Akronyms auffindbar. |
Die hierzulande in der Fachinformation.4 empfohlene Dosierung (initial drei Injektionen in monatlichen Abständen, danach nur bei Verschlechterung um mehr als 5 Buchstaben auf der Sehtafel) ist in keiner der Studien untersucht. Sie wird im europäischen Bewertungsbericht5 damit begründet, dass der hauptsächliche Zugewinn an Sehkraft innerhalb der ersten drei Monate erreicht wird und danach lediglich eine klinisch unbedeutende Verbesserung durch weitere monatliche Injektionen resultiert. Für die offizielle Anwendungsempfehlung ist, da in dieser Form nicht geprüft, letztendlich nicht exakt bestimmbar, welchen Nutzen sie überhaupt hat - auch im Vergleich zu anderen Therapieoptionen wie fotodynamischer Therapie mit Verteporfin (VISUDYNE) oder dem älteren VEGF-Hemmer Pegaptanib (MACUGEN). In den USA ist Ranibizumab für monatliche Injektionen vorgesehen und eine Verlängerung der Therapieintervalle nur für den Fall, dass die monatliche Anwendung nicht möglich ist.6
Die von Novartis geforderten Preise für Ranibizumab sind enorm: Bei monatlicher Injektion liegen die jährlichen Arzneimittelkosten bei 15.550 € pro Patient (Kosten pro Ampulle 1.296€).** Die Hochrechnungen für die gesamtwirtschaftlichen Kosten gehen allerdings weit auseinander. Erhielten in Deutschland alle von feuchter Makuladegeneration Betroffenen (schätzungsweise 485.000 Patienten***) monatlich eine Ampulle Ranibizumab, wären allein für LUCENTIS jährlich 7,5 Milliarden € aufzuwenden, mehr als ein Viertel der Arzneimittelausgaben der GKV. Novartis rechnet die Kosten auf 300 Mio. € klein und behauptet, dass nur etwa 20.000 Betroffene jährlich behandelt würden. Auf welche Patienten die Behandlung beschränkt werden soll, bleibt nebulös. In die Zulassungsstudien sind Patienten mit mäßiger bis schwerer Visusbeeinträchtigung eingeschlossen worden. Die Fachinformation gibt zum Anwendungsgebiet feuchte Makuladegeneration keine Einschränkung vor. Letztlich liegen keine harten Daten zur Zahl der Patienten vor, die von einer Therapie mit einem VEGF-Hemmer profitieren würden oder die die Behandlung konsequent durchführen. Eine realistische Kostenabschätzung ist daher nicht möglich. Mehrere Landesverbände der AOK haben mit Novartis Kostendeckelungs-Verträge abgeschlossen, die die Belastungen für die Versichertengemeinschaft begrenzen sollen. Details sind jedoch nicht bekannt.
| ** | Bei in einigen Apotheken durchgeführter Mehrfachentnahme ca. 680 €/Anwendung. |
| *** | Nach epidemiologischen Daten wird die Häufigkeit der feuchten AMD bei über 65-Jährigen auf 2,3% geschätzt.24 |
Ranibizumab ist ein Fragment der Muttersubstanz Bevacizumab (AVASTIN). Die Antikörper besitzen ähnliche pharmakologische Wirkungen. Bevacizumab ist jedoch nur zur Therapie fortgeschrittener maligner Erkrankungen zugelassen.8 Es wurde aber bereits vor Einführung von Ranibizumab und wird weiterhin international "off label" bei feuchter Makuladegeneration angewendet. Die Behandlung wird hierzulande auf der Basis entsprechender Honorarverträge von den Kassen bezahlt, die ein nachvollziehbares Interesse an einem Umlenken der Therapie auf das deutlich preiswertere Bevacizumab haben (Apothekenpreis für eine Einzeldosis bei Mehrfachentnahme 50 €). Der von den Kassen früher bekämpfte Off-label-Gebrauch wird so wegen der drohenden finanziellen Überforderung selbst in Anspruch genommen. Die Verträge sichern den behandelnden Ärzten bei Verwendung von AVASTIN einen höheren Verdienst - und dies mit richterlichem Segen: Das Sozialgericht Düsseldorf wies trotz eines anders lautenden Urteils des Bundessozialgerichts9 von 2002 zum Off-label-Gebrauch wegen der unzumutbaren Therapiekosten Ende 2008 eine entsprechende Klage des Ranibizumab-Herstellers Novartis ab, der juristisch gegen die Vereinbarungen zwischen Kassen und Vertragsärzten vorgehen wollte.10
So verständlich die Vereinbarungen aufgrund der befürchteten Kostenlawine sind, hinsichtlich der Nutzenbelege bewegt man sich auf dünnem Eis. Die Datenlage zu Bevacizumab ist, gemessen an den Kriterien der evidenzbasierten Medizin, unzureichend. In vier kleinen randomisierten kontrollierten Studien11-14 mit 28 bis 165 Patienten führt intravitreales Bevacizumab (1 mg bis 2,5 mg) nach drei bis sechs Monaten zu besseren Visusergebnissen als fotodynamische Therapie allein10,11 oder PDT in Kombination mit intravitrealem Triamcinolon (VOLON; siehe Tabelle; keine Zulassung für AMD).13,14 Methodisch weisen die Studien deutliche Mängel auf: Trotz offener Durchführung werden die Endpunkte nicht verblindet erhoben, die Auswertung erfolgt nicht gemäß Intention to treat. Die Erfassung unerwünschter Wirkungen ist nicht systematisch dargestellt. Aussagen zu Effektivität und Sicherheit sind daher wenig belastbar. Zudem ist die Nachbeobachtungszeit insgesamt zu kurz. Die Publikation einer verblindet durchgeführten Einjahresstudie mit Bevacizumab im Vergleich zu Pegaptanib, fotodynamischer Therapie oder Scheininjektionen15 steht aus.
Darüber hinaus liegen Fallserien und retrospektive Analysen zu intravitrealem Bevacizumab vor, oft mit methodischen Mängeln, die - entgegen anders lautender Stellungnahmen von Fachgesellschaften16 - eine Nutzen-Risiko-Einschätzung für Bevacizumab nicht erlauben.17 Insbesondere zur Bewertung der Sicherheit sind die vorliegenden Daten, da zu unsystematisch erhoben, unzureichend. Auch ein indirekter Vergleich mit Ranibizumab ist anhand dieser Daten aufgrund der Unsicherheiten und unterschiedlicher Patientenkollektive nicht möglich. Unterschiede hinsichtlich Wirksamkeit und Sicherheit zwischen Ranibizumab und Bevacizumab sind u.a. aufgrund unterschiedlicher Molekülgröße, Verweildauer im Auge und Affinität zu den Rezeptoren denkbar. Ob die in Kanada aufgetretenen schweren Augenentzündungen unter in- travitrealem Bevacizumab bei 25 Patienten18 ein besonderes Risikosignal darstellen, bleibt unklar
(a-t 2009; 40: 15-6). Auch unter Ranibizumab sind in den Zulassungsstudien schwere Augenentzündungen vorgekommen (Endophthalmitis bei 1%, Uveitis bei 0,7%).
Die Behandlung mit Bevacizumab ist nach mehrheitlicher Einschätzung der Redaktion beim derzeitigen Kenntnisstand nur in guten randomisierten Vergleichsstudien zu rechtfertigen. Die Off-label-Anwendung außerhalb von Studien ist aufgrund der schwachen Evidenz nicht abgesichert.
Vergleichsstudien zwischen Bevacizumab und Ranibizumab sind dringend erforderlich, werden aber aus durchsichtigen Gründen von den Firmen nicht gewünscht. Novartis (LUCENTIS) hält 30% der Roche-Aktien (AVASTIN). Mittlerweile wurden mehrere firmenunabhängige kontrollierte Vergleichsstudien zwischen Ranibizumab und Bevacizumab in den USA,19 Holland,20 Österreich,21 Großbritannien22 und Deutschland23 begonnen. Auf Ergebnisse wird man jedoch bis mindestens 2010 warten müssen. Es ist unverständlich, dass weder Politik noch Fachgesellschaften frühzeitig auf das sich abzeichnende finanzielle Debakel reagierten: Dringend wäre die Bereitstellung von öffentlichen Mitteln zur Durchführung einer großen multizentrischen Studie erforderlich gewesen, die eine klare Evidenz zur Wirksamkeit und Sicherheit von Bevacizumab im Vergleich mit Ranibizumab schafft.
Der eigentliche Skandal ist jedoch, dass die Preisgestaltung für Arzneimittel in Deutschland nach wie vor vollständig den Herstellern überlassen bleibt, die den von den Krankenkassen zu zahlenden Preis in der Regel ohne Kontrollen oder Verhandlungen diktieren. Der Gesetzgeber ist nicht erst seit LUCENTIS gefordert, Regelungen zu etablieren, die bereits zum Zeitpunkt der Zulassung für eine Preisgestaltung sorgen, die den finanziellen Rahmen der gesetzlichen Krankenversicherung nicht sprengt.
Mit Ranibizumab (LUCENTIS) existiert eine zugelassene, sehr teure Behandlungsmöglichkeit der feuchten Makuladegeneration. Das hierzulande empfohlene Anwen-dungsregime ist jedoch in keiner Studie geprüft und der Nutzen daher auch im Vergleich zu anderen Therapieoptionen unklar. Anhaltende Visusverbesserung bei einem Teil der Patienten ist nur bei monatlichen Injektionen nachgewiesen.
Mit Bevacizumab (AVASTIN) liegt ein preiswerteres, jedoch in dieser Anwendung nicht zugelassenes Mittel vor, dessen Wirksamkeit mangels guter Studien nicht hinreichend bekannt ist.
Die Sicherheit in dieser Anwendung ist bei Ranibizumab im Gegensatz zu Bevacizumab systematisch geprüft. Schwere ophthalmologische und systemische Nebenwirkungen können unter beiden Mitteln auftreten. Ein Vergleich von Verträglichkeit oder Nutzen ist auf der Basis der derzeitigen Datenlage nicht möglich.
Die intravitreale Anwendung von Bevacizumab ist nach mehrheitlicher Einschätzung der Redaktion aufgrund der schwachen Evidenzlage außerhalb kontrollierter Studien nicht zu rechtfertigen.
Mittel der Wahl bei feuchter Makuladegeneration ist Ranibizumab, das unseres Erachtens jedoch so wie in den Zulassungsstudien geprüft angewendet werden sollte.
Dringend zu fordern sind gesetzliche Regelungen gegen unethisch hohe Preisforderungen von Pharmaherstellern, die den finanziellen Rahmen der gesetzlichen Krankenversicherung sprengen.
| (R = randomisierte Studie) | ||
| R | 1 | ROSENFELD, P.J. et al.: N. Engl. J. Med. 2006; 355: 1419-31 |
| R | 2 | BROWN, D.M. et al.: N. Engl. J. Med. 2006; 355: 1432-44 |
| R | 3 | REGILLO, C.D. et al.: Am. J. Ophthalmol. 2008; 145: 239-48 |
| 4 | Novartis: Fachinformation LUCENTIS, Stand Dez. 2008 | |
| 5 | EMEA: Europ. Beurteilungsbericht (EPAR) LUCENTIS, Stand Dez.
zu finden unter: http://www.emea.europa.eu/htms/human/epar/l.htm | |
| 6 | Genentech: US-amerikanische Produktinformation LUCENTIS, Stand Juni 2006 | |
| 7 | FRICKE U, SCHWABE, U in: SCHWABE, U., PAFFRATH, D. (Hrsg.): Arzneiverordnungsreport 2008, Heidelberg 2008; Seite 89-91 | |
| 8 | Roche: Fachinformation AVASTIN, Stand März 2009 | |
| 9 | Bundessozialgericht: Urteil vom 19. März 2002, B 1 KR 37/00R | |
| 10 | Sozialgericht Düsseldorf: Urteil vom 2. Juli 2008; zu finden unter http://www.justiz.nrw.de/RB/nrwe2/index.php mit Aktenzeichen S 2 KA 181/07 | |
| R | 11 | BASHSHUR, Z.F. et al.: Arch. Ophthalmol. 2007; 125: 1357-61 |
| R | 12 | LAZIC, R., GABRIC, N.: Ophthalmology 2007; 114: 1179-85 |
| R | 13 | HAHN, R. et al.: Ophthalmologe 2007; 104: 588-93 |
| R | 14 | WEIGERT, G.: Br. J. Ophthalmol. 2008; 92: 356-60 |
| 15 | PATEL, P.J. et al.: Trials 2008, 9: 56 | |
| 16 | LANG, G.K. et al.: Klin. Monatsbl. Augenheilkd. 2009; 226: 388-95 | |
| 17 | WILD, C., ADLBRECHT, C.: AVASTIN bei Altersbedingter Makuladegeneration. Rapid Assessment; letzte Änderung 28. März 2008; http://eprints.hta.lbg.ac.at/718/ | |
| 18 | Health Canada: Important Safety Information on AVASTIN, 16. Dez. 2008; http://www.hc-sc.gc.ca/dhp-mps/alt_formats/hpfb-dgpsa/pdf/medeff/avastin_4_pc-cp-eng.pdf | |
| 19 | CATT: LUCENTIS-AVASTIN Trial: Manual of Procedures; Sept. 2008; http://www.med.upenn.edu/cpob/studies/documents/CATTMOPSept2008.pdf | |
| 20 | http://www.who.int/trialsearch?NCR 1331 | |
| 21 | http://www.clinicaltrials.gov?NCTNCT00710229 | |
| 22 | http://www.controlled-trials.com?ISRCTN92166560 | |
| 23 | Clinicaltrials.gov: VIBERA-Studie; registriert am 25. Nov. 2007; http://www.clinicaltrials.gov/ct2/results?term=NCT00559715 | |
| 24 | JOUSSEN, A.M., BORNFELD, N.: Dtsch. Ärztebl. Int. 2009; 106: 312-7 |
© 2009 arznei-telegramm, publiziert am 3. Juli 2009
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
