MIRABEGRON (BETMIGA) BEI ÜBERAKTIVER BLASE
Seit Juni 2014 ist in Deutschland mit Mirabegron (BETMIGA) erstmals ein Beta-3-Rezeptoragonist auf dem Markt, zugelassen zur symptomatischen Behandlung von imperativem Harndrang, erhöhter Miktionsfrequenz und/oder Dranginkontinenz bei Erwachsenen mit überaktiver Blase.1 In Japan ist Mirabegron dafür bereits seit Juli 2011 zugelassen und in den USA seit Juni 2012. Eine ursprünglich angestrebte Indikation bei Typ-2-Diabetes wurde wegen mangelnder Wirksamkeit fallengelassen.2
Das Syndrom der überaktiven Blase wird definiert als Harndrang, der mit oder ohne Dranginkontinenz auftreten kann und häufig mit erhöhter Miktionsfrequenz und nächtlichem Wasserlassen einhergeht, ohne dass ein Harnwegsinfekt oder andere offensichtliche pathologische Veränderungen erkennbar sind.3 Ursächlich sollen unter anderem eine Überaktivität des Blasenmuskels (Detrusor) und eine erhöhte Empfindlichkeit der Blase gegenüber kontraktilen Reizen sein.2 Therapie der Wahl sind nichtmedikamentöse Verfahren wie Verhaltenstherapie und Beckenbodentraining. Eine medikamentöse Behandlung kommt erst in zweiter Linie bei unzureichendem Ansprechen oder Inakzeptanz in Betracht. Im Vordergrund stehen hier Anticholinergika wie Oxybutynin (DRIDASE, Generika), die allerdings nur mäßig effektiv sind und zudem häufig unerwünschte Effekte hervorrufen (a-t 1999; Nr. 6: 60-2).3,4
EIGENSCHAFTEN: Beta-3-Rezeptoren werden vor allem im Fettgewebe gefunden, außerdem beispielsweise in Gehirn, Leber, Gallenblase, Pankreas, Magen-Darm-Trakt, Harnblase und Herz. Ihre Aktivierung kann die Kontraktion der Muskulatur in diesen Organen hemmen und die Gefäßdilatation steigern. In der Blase sind Beta-3-Rezeptoren der dominierende Subtyp.5
Der Beta-3-Agonist Mirabegron weist in vitro allenfalls geringe Aktivität an Beta-1- und -2-Rezeptoren auf. In vivo scheint er jedoch durchaus klinisch relevant beta-1-agonistisch zu wirken: Beispielsweise reagieren gesunde Probanden auf die einmalige Einnahme von 200 mg Mirabegron (entsprechend dem Vierfachen der hierzulande zugelassenen Dosis) mit erhöhter Pulsrate und systolischem Blutdruckanstieg, beides kann durch den spezifischen Beta-1-Antagonisten Bisoprolol (CONCOR, Generika) unterdrückt werden.5
Stimulation cholinerger Muskarinrezeptoren in der Harnblase löst eine Kontraktion der Blasenmuskulatur aus, während adrenerge Stimulation die Detrusorkontraktion abschwächt.5 Mirabegron bewirkt eine Entspannung des Detrusormuskels und soll die Speicherkapazität der Blase erhöhen, ohne den Entleerungsprozess zu stören.1 Ob der beobachtete Effekt jedoch tatsächlich ausschließlich über Beta-3-Rezeptoren vermittelt wird, wie vom Anbieter behauptet, hält der europäische Arzneimittelausschuss für nicht hinreichend belegt und fordert dazu weitere Studien.2

WIRKSAMKEIT: Zum Nutzen von Mirabegron liegen drei zwölfwöchige randomisierte doppelblinde Phase-III-Studien6-8 vor, in denen insgesamt rund 4.600 Patienten mit überaktiver Blase einmal täglich 25 mg, 50 mg oder 100 mg Mirabegron bzw. Plazebo sowie in einer Studie6 als aktive Kontrolle 4 mg retardiertes Tolterodin (DETRUSITOL, Generika) einnehmen. Die Teilnehmer müssen seit mindestes drei Monaten an typischen Beschwerden einer überaktiven Blase leiden und in einem Miktionstagebuch innerhalb eines Zeitraums von drei Tagen mindestens drei Episoden mit Harndrang (Grad 3 oder 4*) mit oder ohne Inkontinenz sowie im Mittel mindestens acht Miktionen innerhalb von 24 Stunden angeben. Ausschlusskriterien sind unter anderem das Vorherrschen von Belastungsinkontinenz, Verdacht auf Harnwegsinfektion, chronische Entzündungen wie interstitielle Zystitis, Blasensteine, diabetische Nephropathie, schwere Hypertonie (definiert als systolischer Blutdruck ≥ 180 mmHg und/oder diastolischer Blutdruck von 110 mmHg) sowie ein klinisch auffälliges EKG. Etwa 70% sind Frauen, 60% bis 65% unter 65 Jahre alt, maximal 15% älter als 75 Jahre.6-8 Die Hälfte hat schon einmal Anticholinergika eingenommen und diese vor allem wegen unzureichender Wirksamkeit (ca. 66%) oder Unverträglichkeit (ca. 26%) abgesetzt. Zwei Drittel der Teilnehmer leiden an Inkontinenz.9 Obwohl die Zahl der Inkontinenzepisoden einer der primären Endpunkte ist und nur in dieser Subgruppe ausgewertet wird, ist die Randomisierung nicht danach stratifiziert.
| * | nach Patient Perception of Intensity of Urgency Scale: 0 = kein Harndrang (H.), 1 = milder H., 2 = mäßiger H., 3 = schwerer H., 4 = Dranginkontinenz8 |
Mirabegron schneidet in allen drei Studien in den beiden primären Endpunkten, der Änderung der Zahl der täglichen Miktionen bzw. Inkontinenzepisoden, signifikant besser ab als das Scheinmedikament (vgl. Tabelle). Der Nutzen ist jedoch recht bescheiden:2,10 Vereinfacht dargestellt kommt es gegenüber Plazebo unter Mirabegron innerhalb von zwei Tagen zu einer Miktion und einer Inkontinenzepisode weniger.11 Das Ausmaß des Effektes entspricht in etwa dem von Tolterodin.2 Ein statistischer Vergleich erfolgt jedoch nicht.6
Auch hinsichtlich der Rate der Patienten, die nach zwölf Wochen nicht mehr inkontinent sind (einer der zahlreichen sekundären Endpunkte; Mirabegron: 44%, Plazebo: 38%),9 ist der Unterschied zumindest in der gepoolten Auswertung zwar statistisch signifikant, mit weniger als 10% Differenz aber nicht gerade eindrucksvoll. Der bescheidene Effekt spiegelt sich in der subjektiven Einschätzung der Teilnehmer bezüglich ihrer Zufriedenheit mit der Behandlung und der Verbesserung ihres Zustands wider: Die in drei verschiedenen Tests ermittelten Ergebnisse liegen alle unterhalb der von der europäischen Arzneimittelbehörde als klinisch bedeutsam eingestuften Schwellenwerte.2
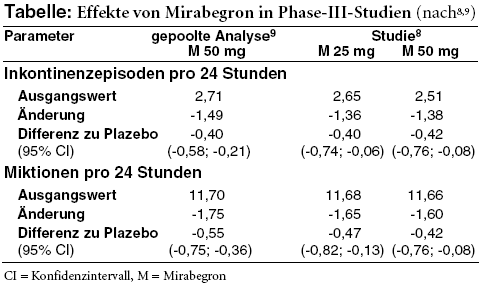
Eine klare Dosis-Wirkungs-Beziehung ist für Mirabegron nicht erkennbar: 100 mg scheinen nicht besser zu wirken als 50 mg. Die 25-mg-Dosis wurde erst auf Wunsch der US-amerikanischen Arzneimittelbehörde FDA in einer der Studien8 mitgeprüft.10 25 mg und 50 mg Mirabegron schneiden dort im Hinblick auf die beiden primären Endpunkte ebenfalls vergleichbar ab (Tabelle). Kleinere Unterschiede ergeben sich lediglich bei einigen der sekundären Endpunkte, beispielsweise hinsichtlich der Geschwindigkeit des Wirkeintritts.8,10 In den USA wird daher initial eine Dosis von 25 mg Mirabegron empfohlen, die bei unzureichender Wirksamkeit nach mindestens achtwöchiger Therapie ggf. auf 50 mg gesteigert werden kann.12
In einem primär auf Sicherheit angelegten zwölfmonatigen randomisierten Vergleich13 von Mirabegron und Tolterodin, an dem überwiegend (> 80%) Patienten aus den Phase-III-Studien teilnehmen, bleibt der Behandlungseffekt während des Beobachtungszeitraums erhalten und entspricht etwa dem des Anticholinergikums. Angesichts der fehlenden Plazebokontrolle ist die Aussagekraft des Ergebnisses jedoch begrenzt.2 Vergleiche mit Oxybutynin fehlen.
Das britische NICE stuft Mirabegron als Alternative für Patienten ein, bei denen Anticholinergika unzureichend wirken, kontraindiziert sind oder die diese nicht vertragen.14
UNERWÜNSCHTE WIRKUNGEN: Häufigste unerwünschte Ereignisse unter 50 mg Mirabegron in den drei Zulassungsstudien sind Hypertonie (7,5%, Plazebo 7,6%), Nasopharyngitis (3,9% versus 2,5%), Tachykardie (3,8% vs. 3,1%), Kopfschmerz (3,4% vs. 3,1%) und Harnwegsinfekt (2,9% vs. 1,8%).9 3,9% setzen das Betamimetikum wegen Störwirkungen ab (Plazebo 3,3%).9 Gegenüber Tolterodin ist kein deutlicher Verträglichkeitsvorteil erkennbar: Zwar klagen unter dem Anticholinergikum sowohl in der Kurzzeitstudie6 als auch im Langzeitvergleich13 erwartungsgemäß mehr Patienten über Mundtrockenheit (2,8% vs. 10,1%6 bzw. 8,6%13). Verstopfung, ebenfalls eine typische Nebenwirkung der Anticholinergika, wird jedoch gleich häufig beobachtet, und auch im Hinblick auf die Rate der Patienten, bei denen überhaupt Störwirkungen auftreten oder die die Behandlung deshalb abbrechen, lassen sich keine Unterschiede zwischen den Behandlungsgruppen erkennen.6,13 Herzrhythmusstörungen kommen allerdings unter Tolterodin numerisch häufiger vor (2,2% vs. 3,2%6 bzw. 3,9% vs. 6,0%13).
In den Zulassungsstudien wird unter 50 mg Mirabegron ein mittlerer Anstieg der Pulsrate um 1 pro Minute und des systolischen und diastolischen Blutdrucks um jeweils 1 mmHg gegenüber Plazebo beobachtet.10 In zwei Phase-I-Studien beträgt die mittlere Blutdruckdifferenz unter dieser Dosis bis zu 3,5 bzw. 1,5 mmHg (systolisch bzw. diastolisch).12 Eine erhöhte Inzidenz kardiovaskulärer Ereignisse lässt sich jedoch nicht feststellen. Ob Mirabegron das Risiko solcher Erkrankungen erhöhen kann, soll in einer epidemiologischen Studie geprüft werden.2,10
In der Langzeitstudie treten unter der 100-mg-Dosis vermehrt Neoplasien, überwiegend Malignome, auf. Eine Häufung bestimmter Tumorarten wird nicht beobachtet.2,10,13 Während die EMA diesem potenziellen Risikosignal keine weitere Bedeutung beimisst und hierzulande in der Fachinformation ein Hinweis darauf fehlt, verlangt die FDA dazu ebenfalls eine Postmarketingstudie.10
Aufgefallen sind in der klinischen Entwicklung zudem (vor allem verzögerte) Hypersensitivitätsreaktionen, bei denen ein Zusammenhang mit Mirabegron nicht ausgeschlossen werden kann.2,10 In den Zulassungsunterlagen der US-amerikanischen Behörde werden zudem einzelne Berichte über schwere Leberschäden beschrieben.10
Nach Markteinführung in Japan und den USA wurde bei Patienten mit Blasenausgangsobstruktion oder gleichzeitiger Einnahme von Anticholinergika gegen überaktive Blase unter Mirabegron Harnverhalt beobachtet. Das Betamimetikum soll daher bei diesen Patienten mit Vorsicht angewendet werden.12 Auch in Europa sollen die Fachinformationen entsprechend geändert werden.15
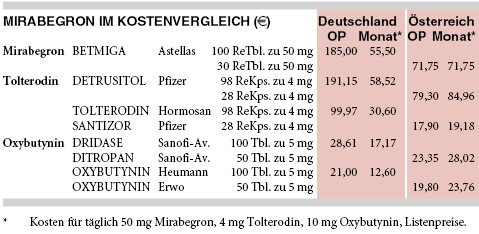
KOSTEN: Für das erste Beta-3-Mimetikum Mirabegron (BETMIGA; tgl. 25 mg oder 50 mg) sind pro Monat 56 € aufzuwenden und damit 80% mehr als für ein preiswertes Tolterodin-Generikum (31 €/Monat für tgl. 4 mg) und das Drei- bis Vierfache gegenüber Oxybutynin (2 x tgl. 5 mg; DRIDASE: 17 €/Monat, OXYBUTYNIN HEUMANN: 13 €/Monat). Packungen mit 25 mg und 50 mg Mirabegron werden zu identischen Preisen angeboten.
Mit Mirabegron (BETMIGA) kommt erstmals ein Beta-3-Mimetikum auf den Markt, zugelassen zur Behandlung von Erwachsenen mit überaktiver Blase.
Der Nutzen von Mirabegron ist bescheiden: Gegenüber Plazebo kommt es in den Zulassungsstudien unter dem Betamimetikum innerhalb von zwei Tagen zu einer Miktion und einem Inkontinenzereignis weniger. Der Effekt entspricht in etwa dem des Anticholinergikums Tolterodin (DETRUSITOL, Generika).
In Tests zur subjektiven Einschätzung des Behandlungserfolgs lässt sich kein klinisch relevanter Vorteil von Mirabegron belegen.
Die Dosierung von Mirabegron ist unzureichend geprüft, eine klare Dosis-Wirkungs-Beziehung nicht erkennbar. In den USA werden initial für alle Patienten 25 mg empfohlen, die erst bei unzureichendem Effekt nach mindestens achtwöchiger Einnahme auf die in Europa vorgesehene Standarddosis von 50 mg gesteigert werden dürfen.
Schwerwiegende Risiken sind in den Zulassungsstudien nicht aufgefallen, die Langzeitsicherheit des neuen Beta-3-Mimetikums ist aber unklar.
Bei überaktiver Blase sind nichtmedikamentöse Verfahren Therapie der Wahl. Alle verfügbaren medikamentösen Therapieoptionen sind nur mäßig effektiv.3 Beim gegenwärtigen Kenntnisstand kommt Mirabegron als Alternative für Patienten mit Inkontinenz in Betracht, bei denen Anticholinergika unzureichend wirken, kontraindiziert sind oder die diese nicht vertragen. Dabei ziehen wir das in den USA zugelassene Dosierungsschema vor.
| (R = randomisierte Studie, M = Metaanalyse) | |
| 1 | Astellas: Fachinformation BETMIGA, Stand Jan. 2014; zu finden über http://www.fachinfo.de (kostenloses DocCheck-Passwort erforderlich) |
| 2 | EMA: Europ. Beurteilungsbericht (EPAR) BETMIGA, Stand 18. Okt. 2012 http://www.a-turl.de/?k=olzs |
| 3 | American Urological Association Guideline: Diagnosis and treatment of overactive bladder (non-neurogenic) in adults, Stand Mai 2014 http://www.a-turl.de/?k=eudi |
| 4 | NOVARA, G., CORNU, J.N.: Eur. Urol. 2013; 63: 306-8 |
| 5 | FDA: Pharmacology Review Mirabegron, Juni 2012 http://www.a-turl.de/?k=abow |
| R 6 | KHULLAR, V. et al.: Eur. Urol. 2013; 63: 283-95 |
| R 7 | NITTI, V.W. et al.: J. Urol. 2013; 189: 1388-95 |
| R 8 | HERSCHORN, S. et al.: Urology 2013; 82: 313-20 |
| M 9 | NITTI, V.W. et al.: Int. J. Clin. Pract. 2013; 67: 619-32 |
| 10 | FDA: Summary Review Mirabegron, Juni 2012 http://www.a-turl.de/?k=lmst |
| 11 | Drug Ther. Bull. 2013; 51: 90-2 |
| 12 | Astellas: US-am. Produktinformation MYRBETRIQ, Stand Juni 2012 |
| R 13 | CHAPPLE, C.R. et al.: Eur. Urol. 2013; 63: 296-305 |
| 14 | NICE: Mirabegron for treating symptoms of overactive bladder, Stand Juni 2013; http://www.a-turl.de/?k=utbu |
| 15 | EMA: EPAR Variation BETMIGA, Stand Febr. 2014 http://www.a-turl.de/?k=avet |
© 2014 arznei-telegramm, publiziert am 4. Juli 2014
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
