TRASTUZUMAB (HERCEPTIN) IN DER ADJUVANTEN BRUSTKREBSTHERAPIE
... gibt es einen Publikationsbias?
Seit Mai 2006 ist der monoklonale Antikörper Trastuzumab (HERCEPTIN) in Europa zur Behandlung von Frauen mit HER2-positivem Brustkrebs im Frühstadium nach einer Operation, Chemotherapie und ggf. Strahlentherapie zugelassen.1 Die Zulassung basiert wesentlich auf den Daten aus einer Zwischenanalyse der multinationalen HERA-Studie,2,3 in der die einjährige Anwendung von Trastuzumab nach Abschluss üblicher Chemotherapieregime beginnt (so genannte sequenzielle Therapie).4 Demgegenüber war die zugelassene Indikation des Antikörpers in den USA zunächst an das Design zweier US-amerikanischer Studien angelehnt: Im Anschluss an vier Zyklen Doxorubicin (ADRIBLASTIN, Generika) plus Cyclophosphamid (ENDOXAN) wurde Trastuzumab dort gleichzeitig mit dem Taxan Paclitaxel (TAXOL, Generika) angewendet (so genannte gleichzeitige Therapie).5 Seit Januar 2008 darf der Antikörper auch in den USA sequenziell verabreicht werden.6
Mitarbeiter und Berater der neuseeländischen Arzneimittelbehörde äußern jetzt den Verdacht auf Publikationsbias: Da eine der wesentlichen klinischen Studien bislang nur selektiv veröffentlicht wurde, könnte der Nutzen des sequenziellen Regimes überschätzt sein.7 In der US-amerikanischen Untersuchung NCCTG-N9831 wurde neben einem Kontrollarm ohne den Antikörper und einem mit gleichzeitiger Therapie in einem dritten Arm auch die sequenzielle Anwendung von Trastuzumab geprüft. Zwischenergebnisse aller drei Arme wurden im Mai 2005 auf dem Kongress der US-amerikanischen Gesellschaft für klinische Onkologie (ASCO) vorgestellt.8 Während die Daten des Kontrollarms und des Studienarms mit gleichzeitiger Behandlung jedoch als - nachträglich geplante - gemeinsame Auswertung mit einer zweiten US-amerikanischen Studie veröffentlicht wurden9 und vergangenes Jahr bereits eine weitere gepoolte Zwischenanalyse nach inzwischen dreijähriger Nachbeobachtung vorgestellt wurde,10 liegen die Ergebnisse des Studienarms zur sequenziellen Therapie bis heute nicht vollständig veröffentlicht vor. Der Grund könnte darin liegen, dass Trastuzumab in diesem Studienarm vergleichsweise schlecht abschneidet: Bei Anwendung nach Abschluss der Paclitaxel-Behandlung lässt sich nach medianer Nachbeobachtung von 1,5 Jahren gegenüber der Kontrollgruppe ohne den Antikörper kein Vorteil hinsichtlich des krankheitsfreien Überlebens nachweisen (103 versus 117 Ereignisse; Hazard Ratio [HR] 0,87; 95% Konfidenzintervall [CI] 0,67-1,13). Beginn der Trastuzumab-Anwendung zeitgleich mit Paclitaxel erweist sich nach diesen Daten der sequenziellen Anwendung als überlegen (53 vs. 84 Ereignisse; HR 0,64; 95% CI 0,46-0,91; a-t 2005; 36: 96-8).8
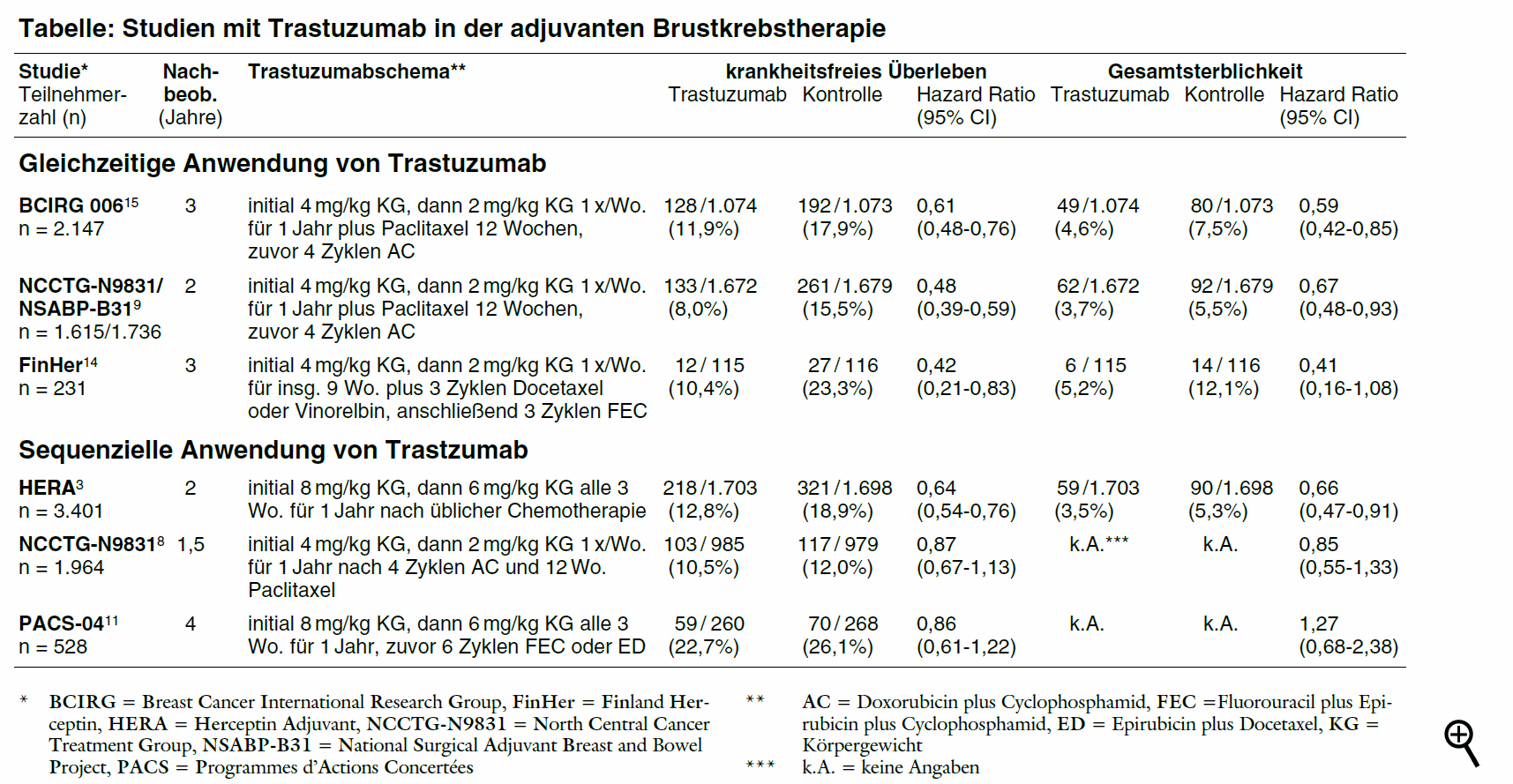
Auch in einer weiteren, bislang ebenfalls nur auf einem Kongress vorgestellten Studie (PACS-04), in der insgesamt 528 Frauen nach Chemotherapie entweder Trastuzumab erhalten oder lediglich beobachtet werden, unterscheiden sich nach knapp vier Jahren weder die Raten des krankheitsfreien Überlebens (primärer Endpunkt; HR 0,86; 95% CI 0,61-1,22) noch die des Gesamtüberlebens (HR 1,27; 95% CI 0,68-2,38).11 Die Studie ist zwar vergleichsweise klein, scheint aber nach der mitgeteilten Fallzahlkalkulation ausreichend gepowert gewesen zu sein. Ein möglicher Grund für das schlechtere Abschneiden von Trastuzumab in dieser Untersuchung im Vergleich zur HERA-Studie könnte in der Dauer der Nachbeobachtung liegen (knapp vier Jahre gegenüber zwei Jahren). In HERA scheint der Nutzen in Bezug auf krankheitsfreies Überleben bei längerer Nachbeobachtung abzunehmen: Der Punktschätzer nach zweijährigem Follow-up liegt nur noch knapp innerhalb des Vertrauensbereichs, der nach einjähriger Nachbeobachtung errechnet wurde (ein Jahr: HR 0,54; 95% CI 0,43-0,67;2 zwei Jahre: HR 0,64; 95% CI 0,54-0,763).12* Werden alle bekannten Daten zur sequenziellen Anwendung von Trastuzumab gepoolt, ergibt sich ein deutlich geringerer Nutzen des Antikörpers (HR 0,72; 95% CI 0,67-0,78).7
Zwar ist verständlich, dass die Initiatoren der NCCTG-Studie weitere Ergebnisse ihres Therapiearms mit sequenzieller Anwendung von Trastuzumab erst bekannt machen wollen, wenn genügend Ereignisse aufgetreten sind, um eine ausreichende statistische Power zu gewährleisten. Das sollte dann aber generell gelten: Statt die Daten zweier Studien nachträglich zu poolen, um schneller an die Öffentlichkeit treten zu können, hätten diese wie ursprünglich vorgesehen (und wie im Übrigen bei der Analyse der Daten zur Kardiotoxizität von Trastuzumab geschehen!), getrennt ausgewertet werden sollen.7
Die Vorgänge machen deutlich, dass das geeignete Behandlungsschema für Trastuzumab noch offen ist. Für die sequenzielle Therapie könnte eine möglicherweise geringere Kardiotoxizität im Vergleich zur Anwendung von Trastuzumab gleichzeitig mit einem Taxan sprechen.13 Auch wurde das in den Studien zur gleichzeitigen Trastuzumabanwendung gewählte Chemotherapieregime als nicht dem Standard entsprechend kritisiert (a-t 2005; 36: 96-8). In einer kleinen finnischen Studie14 sinkt die Rezidivrate in vergleichbarem Ausmaß wie in den großen Studien, wenn der Antikörper neun Wochen lang vor einer Standardchemotherapie gegeben wird. Dabei wird nur ein Fünftel der üblichen Trastuzumabgesamtdosis benötigt (a-t 2007; 38: 18-9), was sich vermutlich nicht nur auf das Budget, sondern auch auf die Verträglichkeit auswirken dürfte. Der Stellenwert einer kürzeren im Vergleich zur derzeit zugelassenen einjährigen Anwendung von Trastuzumab ist dringend in ausreichend großen Studien zu prüfen - aber daran hat Anbieter Roche wohl kein Interesse.
Der monoklonale Antikörper Trastuzumab (HERCEPTIN) wurde in Europa zur adjuvanten Behandlung des Mammakarzinoms im Wesentlichen auf der Basis der HERA-Studie zugelassen. In dieser Untersuchung wird Trastuzumab nach Abschluss üblicher Chemotherapieregime angewendet (sequenzielle Therapie).
Der Nutzen dieses sequenziellen Regimes könnte überschätzt sein: In einer weiteren Studie und in einem von insgesamt drei Therapiearmen, beide nur auf Kongressen vorgestellt, lässt sich kein Einfluss von sequenziell angewendetem Trastuzumab auf das krankheitsfreie Überleben nachweisen.
Wir fordern die rasche Veröffentlichung aller Daten zu Trastuzumab in der adjuvanten Brustkrebstherapie.
Beim derzeitigen Stand der veröffentlichten Kenntnis ist unsere ältere Empfehlung, die sequenzielle Therapie gemäß dem HERA-Schema zu bevorzugen, nicht mehr aufrecht zu erhalten. Die optimale Anwendung von Trastuzumab bleibt offen. Der zeitgleiche Gebrauch mit einem Taxan scheint nach derzeitiger Datenlage überlegen zu sein, allerdings möglicherweise auch schlechter verträglich.
| (R = randomisierte Studie) | ||
| 1 | Roche: Fachinformation HERCEPTIN, Stand April 2007T | |
| R | 2 | PICCART-GEBHART, M.J. et al.: N. Engl. J. Med. 2005; 353: 1659-72 |
| R | 3 | SMITH, I. et al.: Lancet 2007; 369: 29-36 |
| 4 | Roche: Schreiben vom 11. und 13. April 2006 | |
| 5 | Genentech: US-am. Produktinformation HERCEPTIN, Stand Nov. 2006 | |
| 6 | Genentech: US-am. Produktinformation HERCEPTIN, Stand Jan. 2008 | |
| 7 | METCALFE, S. et al.: Lancet 2008; 371: 1646-8 | |
| 8 | PEREZ, E.A. et al.: Further Analysis of NCCTG-N9831; Präsentation auf der ASCO 2005; zu finden unter http://www.asco.org/ASCO/Abstracts+ %26+Virtual+Meeting/Virtual+Meeting?&vmview=vm_session _presentations_view&confID=34&sessionID=934 ? Slides anklicken | |
| R | 9 | ROMOND, E.H. et al.: N. Engl. J. Med. 2005; 353: 1673-84 |
| 10 | PEREZ, E.A. et al.: J. Clin. Oncol. 2007; 25 (Suppl. 18): 512 (Abstract) | |
| R | 11 | SPIELMANN, M. et al.: Trastuzumab following adjuvant chemotherapy in node-positive, HER2-positive breast-cancer patients: 4-year follow-up results of the PACS-04 trial; zu finden unter http://www.sabcs.org/ ? Daily Slide Reviewer ? Presentations ? Day 4 ? General Session 7 |
| 12 | HIND, D. et al.: Lancet 2007; 369: 3-5 | |
| 13 | PEREZ, E.A. et al.: J. Clin. Oncol. 2008; 26: 1231-8 | |
| R | 14 | JOENSUU, H. et al.: N. Engl. J. Med. 2006; 354: 809-20 |
| R | 15 | SLAMON, D. et al.: Phase III Trial comparing AC-T with AC-TH and with TCH in the Adjuvant Treatment of HER2 positive Early Breast Cancer Patients: 2. Interim Efficacy Analysis; http://www.bcirg.org/NR/rdonlyres/eqkdodg2dy7t557o7s6uvj7ytpe6gcfg5gmh2ely6hnhh5pjlabz3nd6jddlnao7qoikej3edohsijyiisfvp367uuc/BCIRG006+2nd+Interim+Analysis.pdf |
| * | In einer Sensitivitätsanalyse, in der das erhebliche Crossover nach Bekanntwerden der Einjahresergebnisse berücksichtigt wird, indem Frauen der Kontrollgruppe ab dem Zeitpunkt des Beginns der Trastuzumabanwendung zensiert werden, ergibt sich ein ähnliches Ergebnis (HR 0,63; 95% CI 0,53-0,75).3 |
© 2008 arznei-telegramm, publiziert am 6. Juni 2008
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
