AKUTES KORONARSYNDROM: PRASUGREL (EFIENT) STATT CLOPIDOGREL (PLAVIX U.A.)?
Bei Koronarangioplastie (PCI) mit Einlage von Stents ist die zeitlich befristete doppelte Hemmung der Thrombozytenaggregation mit Clopidogrel (PLAVIX, Generika) zusätzlich zur langfristigen Einnahme von Azetylsalizylsäure (ASS; ASPIRIN, Generika) seit Jahren etabliert. Dies gilt auch für die PCI im Rahmen des akuten Koronarsyndroms.1-7 Die Anwendung ist aufgrund des Kenntnisstandes und einhelliger Leitlinienempfehlungen medizinischer Standard (siehe Kasten Seite 35). Das jetzt eingeführte Prasugrel (EFIENT), ein Thienopyridin wie Ticlopidin (TIKLYD, Generika) und Clopidogrel, ist für die bis zu 12-monatige Zusatzbehandlung von Patienten mit akutem Koronarsyndrom mit oder ohne ST-Hebung zugelassen, die primär oder verzögert koronarangioplastisch behandelt werden.8
EIGENSCHAFTEN: Wie Clopidogrel ist auch Prasugrel ein Prodrug. Die aktiven Metaboliten beider Wirkstoffe hemmen die Thrombozytenaggregation durch irreversible Blockierung eines Adenosindiphosphatrezeptors. Eine Aufsättigungsdosis von 40 mg oder 60 mg Prasugrel führt schneller zu einer stärkeren Plättchenhemmung als Clopidogrel in der Standard-Loadingdose von 300 mg. Eine Erhaltungsdosis von täglich 10 mg Prasugrel hemmt die Plättchenfunktion ebenfalls stärker als Clopidogrel in der Tagesdosis von 75 mg.9

KLINISCHE WIRKSAMKEIT: Der Hersteller Lilly hat als Wirksamkeitsnachweis für die Zulassung die schon 2007 publizierte randomisierte doppelblinde TRITON-TIMI*-38-Studie11 vorgelegt. 13.608 Patienten mit akutem Koronarsyndrom - instabile Angina pectoris (19%), Nicht-ST-Hebungs- (55%) und ST-Hebungsinfarkt (26%) -, bei denen eine primäre oder verzögerte PCI vorgesehen ist, nehmen teil. Sie werden randomisiert einer Therapie mit einmal 60 mg, anschließend täglich 10 mg Prasugrel oder einmal 300 mg und anschließend täglich 75 mg Clopidogrel zugeteilt. Patienten mit ST-Hebungsinfarkt und Symptombeginn von weniger als 12 Stunden, bei denen daher eine primäre PCI angezeigt ist, können sofort nach Diagnosestellung randomisiert werden, bei allen anderen muss vor der Randomisierung klar sein, ob die koronare Anatomie für eine PCI geeignet ist, d.h. sie werden gegebenenfalls erst nach diagnostischer Angiographie randomisiert. Die Aufsättigungsdosis kann zu irgendeinem Zeitpunkt nach der Randomisierung bis eine Stunde nach Verlassen des Katheterlabors eingenommen werden. Die Begleittherapie wie der Gebrauch von Glykoproteinblockern oder die Wahl des Stents wird den behandelnden Ärzten überlassen. Die Studienmedikation soll bis zu 15 Monate lang eingenommen werden. Eine Begründung für die Therapiedauer fehlt. Zu den Ausschlussgründen gehören erhöhtes Blutungsrisiko, Behandlung mit einem Thienopyridin in den fünf Tagen vor der PCI, kurz zurückliegende Fibrinolyse, hämorrhagischer Schlaganfall in der Vorgeschichte, ischämischer Schlaganfall innerhalb von drei Monaten vor Studienbeginn sowie kardiogener Schock und Herzinsuffizienz NYHA IV. Primärer Endpunkt ist die Kombination aus Herzinfarkt, Schlaganfall und kardiovaskulär bedingtem Tod. Zu den Herzinfarkten werden auch die häufig klinisch stummen so genannten periprozeduralen Infarkte gerechnet, deren Diagnose hauptsächlich auf (Wieder-)Anstieg des Nekroseenzyms CK-MB beruht.10-12
| * | TRITON = Trial to Assess Improvement in Therapeutic Outcomes by Optimizing Platelet Inhibition with Prasugrel TIMI = Thrombolysis in Myocardial Infarction |
CLOPIDOGREL-LOADINGDOSE BEI PCI IM RAHMEN DES AKUTEN KORONARSYNDROMS
Mit der Aufsättigungsdosis soll die verzögert einsetzende plättchenhemmende Wirkung von Clopidogrel kompensiert werden. Die Loadingdose beträgt üblicherweise 300 mg, bei dringlicher Indikation für eine PCI werden in manchen Leitlinien inzwischen auch 600 mg empfohlen.2,3,5,6 In diesen Situationen soll die Aufsättigungsdosis zudem so rasch wie möglich eingenommen werden. Auch Leitlinien, die eine routinemäßige Behandlung vor der diagnostischen Angiographie nicht vorsehen - um ein erhöhtes Blutungsrisiko bei Patienten zu vermeiden, deren Erkrankung für eine PCI ungeeignet ist und die statt dessen operativ behandelt werden müssen - empfehlen die Einnahme der Loadingdose noch vor der PCI.1,4 Dass in diesen Situationen eine sofortige Bypassoperation erforderlich wird, gilt jedoch als selten. In anderen Leitlinien wird daher für die dringliche PCI beim akuten Koronarsyndrom mit oder ohne ST-Hebung die frühest mögliche Einnahme der Aufsättigungsdosis empfohlen.2,3,5,7 Der Nutzen der Vorbehandlung mit Clopidogrel ist durch mehrere PCI-Studien dokumentiert.13-15
Bei 99% der Studienteilnehmer wird eine PCI durchgeführt, 94% erhalten Stents, 47% beschichtete Stents. 99% nehmen ASS ein, bei nahezu allen wird Heparin oder ein anderes Antikoagulans, bei 55% ein Glykoproteinblocker verwendet. 26% nehmen die Aufsättigungsdosis des Thienopyridins vor der PCI ein, die übrigen zu einem späteren Zeitpunkt. Auch in der Subgruppe der Herzinfarktpatienten mit primärer PCI werden nur 31% vorbehandelt.11,16
Im medianen Studienverlauf von 14,5 Monaten erleiden unter Prasugrel 643 der Patienten (9,4%) ein Ereignis des primären Endpunkts im Vergleich zu 781 (11,5%) unter Clopidogrel (Hazard ratio [HR] 0,81; 95% CI 0,73-0,90; Number needed to treat [NNT] = 48). Signifikant vermindert werden nur nichttödliche Herzinfarkte (7% vs. 9,1%; NNT = 48), die kardiovaskuläre Sterblichkeit (2% vs. 2,2%) und die Schlaganfallrate (jeweils 0,9%) unterscheiden sich nicht. Auch die Gesamtsterblichkeit ist gleich (2,8% vs. 2,9%).11
Die Komplikationen konzentrieren sich erwartungsgemäß zu Studienbeginn: 23% aller Ereignisse des primären Endpunkts treten in der ersten Stunde auf, 45% am ersten Tag und 54% in der ersten Woche.17 Auch der Vorteil von Prasugrel wird hauptsächlich in den ersten 30 Tagen erzielt. In der durch stratifizierte Randomisierung gebildeten Subgruppe der Patienten mit ST-Hebungsinfarkt ist die Differenz zu Clopidogrel bei Studienende etwas geringer als nach 30 Tagen. Bei den übrigen nimmt sie im Studienverlauf noch etwas zu.16,17 Nach einer bisher nicht vollständig publizierten explorativen Analyse, in der die ersten 30 Tage und der Verlauf danach getrennt betrachtet werden, ist der Zusatznutzen von Prasugrel jenseits der ersten 30 Tage nicht mehr signifikant.18 Die Subgruppe der mindestens 75 Jahre alten Patienten scheint nicht von Prasugrel zu profitieren (primärer Endpunkt bei 16% vs. 17%), bei den Patienten mit transitorischer ischämischer Attacke (TIA) oder Schlaganfall in der Vorgeschichte schneidet Prasugrel tendenziell schlechter ab (19,1% vs. 14,1%). Ihr Schlaganfallrisiko steigt signifikant (6,5% vs. 1,2%; Number needed to harm [NNH] = 19).10 Bei Schlaganfall oder TIA in der Vorgeschichte ist Prasugrel kontraindiziert.8
UNERWÜNSCHTE WIRKUNGEN: Blutungen aller Schweregrade nehmen in der Zulassungsstudie unter Prasugrel signifikant zu: schwerwiegende insgesamt von 1,7% auf 2,2% (NNH = 200), lebensbedrohliche von 0,8% auf 1,3% (NNH = 200) und tödliche von 0,1% auf 0,3% (NNH = 500). Auch bei den Patienten, bei denen schließlich ein koronarer Bypass gelegt wird (3,2% der Gesamtgruppe), sind schwerwiegende Blutungen unter der Neuerung signifikant häufiger (11,3% vs. 3,6%; NNH = 14). Tödliche Blutungen (0,9%) kommen hier nur unter Prasugrel vor. In der Subgruppe der mindestens 75-Jährigen ist das Risiko tödlicher Blutungen (1% vs. 0,1% unter Clopidogrel) ebenfalls deutlich erhöht.10 Nach einer explorativen Analyse scheinen schwerwiegende Blutungen unter Prasugrel in den ersten 30 Tagen numerisch, im Zeitraum danach signifikant zuzunehmen.18
Nach Post-hoc-Auswertungen der US-amerikanischen Arzneimittelbehörde FDA wird in der Zulassungsstudie unter Prasugrel - bei Ausschluss von nichtmelanotischem Hautkrebs - eine Zunahme neu diagnostizierter Malignome beobachtet (1,3% vs. 1,0%), die sich, anders als der Anbieter es sehen will, nicht durch verstärkte Diagnostik wegen häufigerer Blutungen unter der Neuerung erklärt. Die Inzidenzkurven trennen sich jenseits des vierten Studienmonats. Die Differenz nimmt dann fortlaufend zu. Auch die Sterblichkeit an neu diagnostiziertem Krebs ist unter Prasugrel höher (0,4% vs. 0,3%). Eine Erklärung hierfür gibt es nicht. Diskutiert wird neben der Möglichkeit eines Zufallsbefundes ein stimulierender Effekt auf die Tumorausbreitung. In vier großen plazebokontrollierten Studien mit Clopidogrel und insgesamt knapp 50.000 Teilnehmern findet sich kein entsprechendes Signal. Während die hiesige Prasugrel-Fachinformation8 das Risikosignal mit keinem Wort erwähnt, fordern FDA-Reviewer für den Fall der Zulassung einen entsprechenden Warnhinweis. Gefordert wird zudem, die Frage der Tumorstimulierung in einer weiteren randomisierten Studie mit Prasugrel bei medikamentös behandeltem akuten Koronarsyndrom mit zu prüfen.10
NUTZEN-SCHADEN-BILANZ ZU GUNSTEN VON PRASUGREL? Bei akutem, durch PCI versorgtem Koronarsyndrom würden durch Prasugrel im Vergleich zu Clopidogrel nach der TRITON-TIMI-38-Studie pro 1.000 Patienten
21 nichttödliche Herzinfarkte
verhindert.
Dafür wären pro 1.000 Patienten
2 tödliche Blutungen,
3 nichttödliche schwerwiegende Blutungen (intrakranielle oder Hb-Abfall ≥ 5 g/dl) sowie
5 weitere nichttödliche Blutungen (Hb-Abfall ≥ 3 g/dl, aber < 5 g/dl)
in Kauf zu nehmen, möglicherweise auch
3 neue maligne Tumoren.
Unbeeinflusst blieben Sterblichkeit und Schlaganfallrate.
Diese Bilanz lässt allerdings den zeitlichen Verlauf unberücksichtigt. Während der Nutzen überwiegend in den ersten Studientagen und -wochen dokumentiert ist, halten die Risiken unter der Langzeiteinnahme an oder nehmen sogar zu. Den Daten der TRITON-TIMI-38-Studie lässt sich ein optimaler Behandlungszeitraum nicht entnehmen. Sie wurde, wie zuvor schon eine entsprechende plazebokontrollierte Studie mit Clopidogrel,13,19 nicht auf die Ermittlung einer für die Patienten optimalen, sondern als Zulassungsgrundlage für eine möglichst lange Akuttherapie angelegt.
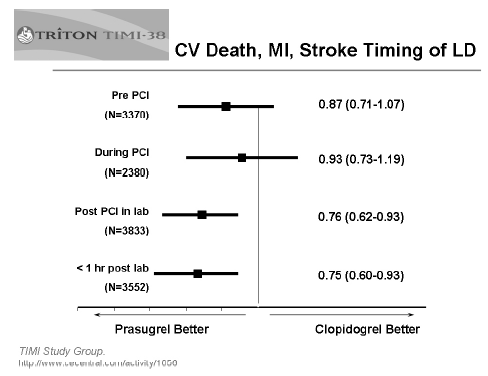
Offen bleibt zudem, inwieweit der Vorteil von Prasugrel darauf beruht, dass die Kontrollgruppe nicht standardgemäß therapiert wurde. Der Nutzen einer Vorbehandlung mit Clopidogrel bei PCI im Rahmen eines akuten Koronarsyndroms13,14 war vor Beginn der TRITON-TIMI-38-Studie bekannt. Durch den zeitlichen Rahmen für die Einnahme der Aufsättigungsdosis, wie er im TRITON-Protokoll vorgegeben war, wurde eine Unterversorgung der Clopidogrelgruppe offensichtlich einkalkuliert: Es ist sonst nicht nachvollziehbar, warum die Loadingdose bis eine Stunde nach Verlassen des Katheterlabors eingenommen werden konnte. Die Rechnung scheint aufgegangen zu sein: Nach einem Dia (siehe Seite 36), das einer der Studienleiter 2007 auf einer Fortbildungsveranstaltung präsentiert hat,20** scheint sich nur bei denjenigen Studienteilnehmern ein signifikanter Vorteil von Prasugrel hinsichtlich des primären Endpunkts zu ergeben, die die Loadingdose (LD) erst nach der PCI eingenommen haben. Entsprechende Daten vermissen wir in der Publikation der Studie, in der nicht einmal hinreichend aufgeschlüsselt wird, wann die Aufsättigungsdosis tatsächlich eingenommen wurde.
| ** | Das Dia wurde uns von einem Kritiker der TRITON-TIMI-38-Studie überlassen,20 der es selbst für einen Vortrag während der öffentlichen FDA-Anhörung zu Prasugrel verwendet hat.21 Der Kritiker hat Interessenkonflikte: Er ist Mitinhaber eines US-Patents für Prasugrel und hat dafür eine Abfindung erhalten, er hat Fördergelder von Lilly und Sanofi erhalten und Beraterhonorare von Sanofi.21,22 |
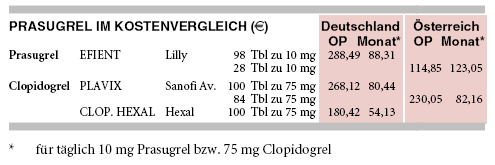
KOSTEN: Das neue Thienopyridin Prasugrel (EFIENT) wird mit 88 € pro Monat für täglich 10 mg 10% teurer angeboten als das Clopidogrel-Original PLAVIX (80 € pro Monat für täglich 75 mg) und gut 60% teurer als ein Clopidogrel-Generikum (CLOPIDOGREL HEXAL: 54 € pro Monat).
Das neue Thienopyridin Prasugrel (EFIENT) senkt in der TRITON-TIMI-38-Studie bei Patienten mit interventionell behandeltem akutem Koronarsyndrom im Vergleich zu Clopidogrel (PLAVIX, Generika) die Rate nichttödlicher Herzinfarkte. Sterblichkeit und Schlaganfallrate unterscheiden sich nicht.
Blutungskomplikationen aller Schweregrade nehmen unter Prasugrel zu. Ungeklärt ist eine Zunahme neuer Malignome unter Prasugrel.
Eine optimale Dauer der Akuttherapie ist den Studiendaten nicht zu entnehmen. Nach explorativen Analysen scheint jenseits von 30 Tagen der Zusatznutzen von Prasugrel nicht mehr signifikant zu sein, während das Risiko schwerer Blutungen in dieser Zeit signifikant zunimmt.
Durch das Studiendesign, das einen nicht standardgemäßen, sehr späten Therapiebeginn erlaubt, wurde ein großer Teil der Kontrollgruppe einer Unterversorgung ausgesetzt. Ob Prasugrel bei standardgemäßem, möglichst frühem Einnahmebeginn Vorteile gegenüber Clopidogrel bietet, ist nicht belegt.
Beim derzeitigen Kenntnisstand sehen wir keine Indikation für Prasugrel.
| (R = randomisierte Studie) | ||
| 1 | ANTMAN, E.M. et al.: ACC/AHA Guidelines for the Management of Patients With ST-Elevation Myocardial Infarction, 2004; http://www.acc.org/qualityandscience/clinical/guidelines/stemi/Guideline1/index.pdf | |
| 2 | Deutsche Gesellschaft für Kardiologie - Herz- und Kreislaufforschung e.V. German Cardiac Society: Positionspapier zur Vermeidung von Tod und lebensbedrohlichen Komplikatonen nach koronarer Stentimplantation durch die zusätzliche Gabe von Clopidogrel http://www.bnk.de/uploads/media/DGK-PP-Clopidogrel.pdf | |
| 3 | BASSAND, J.P. et al.: Eur. Heart J. 2007; 28: 1598-660 http://www.escardio.org/guidelines-surveys/esc-guidelines/GuidelinesDocuments/guidelines-NSTE-ACS-FT.pdf | |
| 4 | ANDERSON, J.L. et al.: J. Am. Coll. Cardiol. 2007; 50: Nr. 7 http://content.onlinejacc.org/cgi/reprint/50/7/e1.pdf | |
| 5 | VAN DE WERF, F. et al.: Eur. Heart J. 2008; 29: 2909-45; http://www.escardio.org/guidelines-surveys/esc-guidelines/GuidelinesDocuments/guidelines-AMI-FT.pdf | |
| 6 | HARRINGTON, R.A. et al.: Chest 2008; 133: 670-707 | |
| 7 | GOODMAN, S.G. et al.: Chest 2008; 133: S708-75 | |
| 8 | Lilly/Daiichi Sankyo: Fachinformation EFIENT, Stand März 2009 | |
| R | 9 | JERNBERG, T. et al.: Eur. Heart J. 2006; 27: 1166-73 |
| 10 | FDA: Briefing Document, Advisory Committee Meeting 3. Febr. 2009 http://www.fda.gov/ohrms/dockets/ac/09/briefing/2009-4412b1-01-FDA.pdf | |
| R | 11 | WIVIOTT, S.D. et al.: N. Engl. J. Med. 2007; 357: 2001-15 |
| 12 | WIVIOTT, S.D. et al.: Am. Heart J. 2006; 152: 627-35 | |
| R | 13 | MEHTA, S.R. et al.: Lancet 2001; 358: 527-33 |
| R | 14 | STEINHUBL, S.R. et al.: JAMA 2002; 288: 2411-20 |
| R | 15 | SABATINE, M.S. et al.: JAMA 2005; 294: 1224-32 |
| R | 16 | MONTALESCOT, G. et al.: Lancet 2009; 373: 723-31 |
| 17 | UNGER, E.F. (FDA): Diavortrag Advisory Committee Meeting 3. Febr. 2009; http://www.fda.gov/ohrms/dockets/ac/09/slides/2009-4412s1-01-FDA.pdf | |
| 18 | KAUL, S. et al.: Circulation 2008; 118: S818-9 (Abstr. 4014) | |
| R | 19 | CURE Trial Investigators: N. Engl. J. Med. 2001; 345: 494-502 |
| 20 | SEREBRUANY, V.S.: Schreiben vom 20. März 2009 | |
| 21 | SEREBRUANY, V.S.: FDA-Advisory Committee Meeting 3. Febr. 2009; http://www.fda.gov/ohrms/dockets/ac/09/slides/2009-4412s1-03-OPH.pdf | |
| 22 | SEREBRUANY, V.S.: N. Engl. Med. 2008; 358: 1298 |
© 2009 arznei-telegramm, publiziert am 3. April 2009
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
