AFLIBERCEPT (EYLEA) BEI FEUCHTER MAKULADEGENERATION
Mit dem Fusionsprotein Aflibercept (EYLEA) ist seit Dezember 2012 ein weiterer Hemmstoff des vaskulären endothelialen Wachstumsfaktors VEGF zur intravitrealen Injektion bei feuchter Makuladegeneration auf dem Markt. Der Angriffspunkt gleicht dem des in dieser Indikation zugelassenen Ranibizumab (LUCENTIS) bzw. dem des off label angewendeten, gegen verschiedene Krebsformen zugelassenen Bevacizumab (AVASTIN, a-t 2011; 42: 45-6).
EIGENSCHAFTEN: Aflibercept ist ein rekombinant in Ovarialzellen des chinesischen Hamsters hergestelltes Fusionsprotein aus Anteilen menschlicher VEGF-1- und -2-Rezeptoren und dem Fc-Fragment von humanem IgG1. Aflibercept bindet als löslicher „falscher” Rezeptor an VEGF und dem Plazenta-Wachstumsfaktor* (PIGF) und verhindert dadurch die Aktivierung der endothelial gelegenen VEGF-Rezeptoren, die eine Schlüsselfunktion bei der choroidalen Neovaskularisation haben.1

KLINISCHE STUDIEN: In zwei identischen, einzeln sowie gepoolt ausgewerteten, an 326 Zentren durchgeführten Zulassungsstudien (VIEW 1 und VIEW 2)2** erhalten 2.419 Patienten mit feuchter Makuladegeneration eine von vier intravitrealen Behandlungsoptionen über jeweils ein Jahr: Monatlich 0,5 mg Aflibercept, monatlich 2 mg Aflibercept, monatlich 2 mg Aflibercept über drei Monate, danach 2 mg alle zwei Monate (jetzt zugelassenes Regime) oder aber monatlich 0,5 mg Ranibizumab. In den vier Behandlungsgruppen beider Studien liegt der Anteil der Patienten mit nur geringem Verlust der Sehkraft nach 52 Wochen, definiert als Verlust von weniger als 15 Buchstaben auf der ETDRS***-Sehtafel, zwischen 94,4% und 96,3% (primärer Endpunkt). Alle Aflibercept-Behandlungsarme sind gegenüber Ranibizumab „nicht unterlegen” und erreichen die präspezifizierten Kriterien für Äquivalenz.2 Überlegenheit wird in keinem der Endpunkte demonstriert (s. Tabelle).
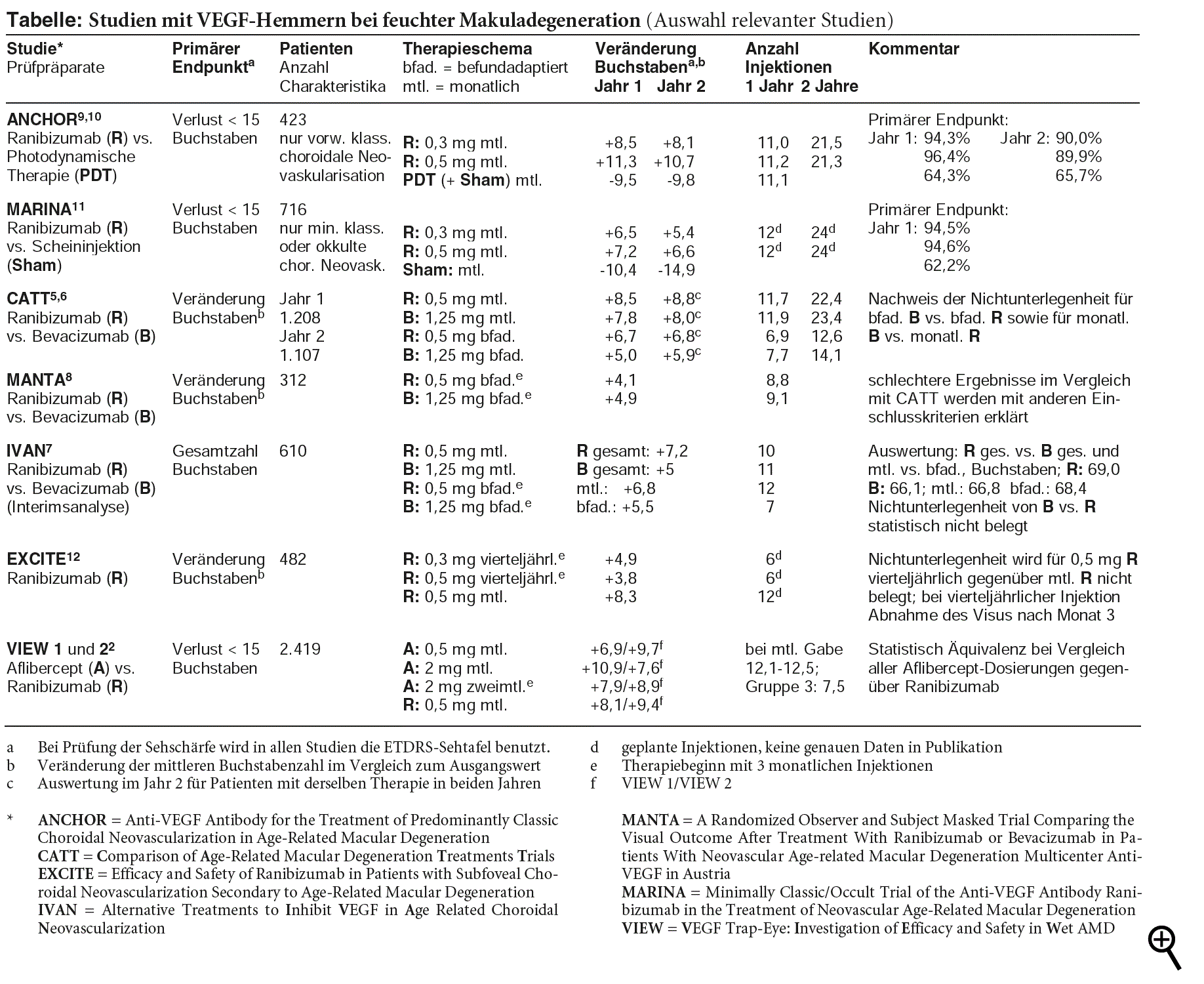
Es ergeben sich ebenfalls keine statistisch signifikanten Unterschiede bei sekundären Endpunkten wie mittlere Anzahl der „gewonnenen” Buchstaben auf der Lesetafel (7-11), Anteil der Patienten mit einer Verbesserung von mindestens 15 Buchstaben (25% bis 37%) oder sehbedingter Lebensqualität (NEI VFQ-25****). Das von der europäischen Arzneimittelbehörde EMA zugelassene Dosierungsregime wird als gleichwertig gegenüber den monatlichen Injektionen bei geringerer Belastung eingestuft.1 Der Vergleich mit Ranibizumab ist zwar adäquat gewählt, allerdings entspricht das in der Studie verwendete fixe Behandlungsregime weder der gültigen Dosierungsvorschrift für Ranibizumab in der Fachinformation noch den Empfehlungen der Fachgesellschaften (siehe Kasten)
BESTANDSAUFNAHME: BEHANDLUNG DER MAKULADEGENERATION MIT VEGF-HEMMERN
In der Auseinandersetzung um die geeignete Behandlung der altersbedingten Makuladegeneration (AMD) mit Hemmern des vaskulären endothelialen Wachstumsfaktors VEGF stehen neben der Wirksamkeit das Störwirkungsprofil und Kostenaspekte im Mittelpunkt. Aber auch Dosierungsintervalle bzw. Steuerung der Behandlung sind Gegenstand der Diskussion (siehe auch a-t 2007; 38: 19-22).
AUSWAHL: Pegaptanib (MACUGEN), der erste zugelassene VEGF-Hemmer, spielt aufgrund schlechterer Wirksamkeit eine untergeordnete Rolle.3 Die Fachgesellschaften empfehlen zwar aktuell die in der Indikation zugelassenen Abkömmlinge Ranibizumab (LUCENTIS) und Aflibercept (EYLEA) als Mittel der Wahl, weisen aber auch auf Bevacizumab (AVASTIN) als Off-label-Alternative hin.4 Dies mit gutem Grund: Die Arzneimittelkosten für Bevacizumab liegen bei optimaler „Auseinzelung” der zur Krebstherapie zugelassenen AVASTIN-Ampullen mehr als 90% unter dem Preis für Ranibizumab oder Aflibercept. Drei größere randomisierte Studien (CATT,5,6 IVAN7 und MANTA8)* zum Vergleich von Bevacizumab und Ranibizumab liegen mittlerweile vor (siehe Tabelle S. 20). In CATT und IVAN wird zusätzlich die monatliche Injektion mit befundadaptierter Behandlung verglichen. In allen drei Untersuchungen erscheint der Nutzen beider VEGF-Hemmer ähnlich – zumindest bei gleicher Therapiestrategie.
Die Zahl schwerwiegender unerwünschter systemischer Ereignisse ist in CATT nach zwei Jahren unter Bevacizumab höher als unter Ranibizumab (39,9% vs. 31,7%; p = 0,009), unterscheidet sich jedoch in IVAN und MANTA nicht. Anders als zu erwarten wäre, ist zudem in CATT das Risiko für ein schwerwiegendes Ereignis unter befundadaptierter Behandlung größer als bei monatlichen Injektionen. Die Störwirkungen verteilen sich auf alle Organsysteme. Arteriothrombotische Ereignisse – die man den Folgen einer VEGF-Blockade zuordnen könnte – sind in IVAN unter Ranibizumab sogar häufiger. Ein eindeutiges Risikosignal für Bevacizumab sehen wir daher nicht. Aufgrund der aktuellen Studien erachten wir nach ausführlicher Aufklärung der Patienten auch angesichts der neuen Sicherheitsdaten die Behandlung mit Bevacizumab off label für vertretbar (siehe auch a-t 2011; 42: 61-2).
INJEKTIONSINTERVALLE: Seit den Zulassungsstudien mit Ranibizumab,9-11 in denen monatlich intravitreal injiziert wurde, werden Therapieregime mit selteneren Injektionen geprüft, um Patienten zu entlasten und Kosten zu sparen. Fixe vierteljährliche Injektionen scheinen zu schlechteren Ergebnissen zu führen (EXCITE-Studie).12 Favorisiert wird eine befundadaptierte Behandlung.4 Die Dosierungsempfehlungen bzw. -vorschriften sind jedoch verwirrend. Die europäische Arzneimittelbehörde EMA hat nach Neuauswertung der mit Ranibizumab durchgeführten Untersuchungen die bisherige Dosierungsvorschrift geändert: „…monatliche Injektionen, bis der maximale Visus erreicht ist.” Dies wird angenommen, „… wenn der Visus an drei aufeinander folgenden Messungen konstant bleibt.”13 Ein solches Vorgehen ist jedoch in keiner der publizierten Studien mit Ranibizumab geprüft, sondern ist offensichtlich Resultat eines nicht näher beschriebenen mathematischen Modells. In Untersuchungen mit adaptiertem Vorgehen wird entweder von Beginn an (zum Beispiel CATT) oder nach drei initialen monatlichen Injektionen (z.B. IVAN, MANTA) in Abhängigkeit von Visus und optischer Kohärenztomographie (OCT; z.B. Nachweis subretinaler Flüssigkeit, Netzhautverdickung) behandelt.
Die Fachgesellschaften empfehlen grundsätzlich für Aflibercept, Ranibizumab und Bevacizumab die befundadaptierte Therapie (Visus plus OCT) nach Therapieeinleitung mit drei monatlichen Injektionen.12 Die Evidenz für dieses Vorgehen reicht für Ranibizumab und Bevacizumab aus. Für Aflibercept, das in den Zulassungsstudien weder so untersucht noch so zugelassen ist, wurden die Resultate extrapoliert.
| * | Erläuterung der Studien-Akronyme siehe *-Text in Tabelle |
STÖRWIRKUNGEN: Komplikationen am behandelten Auge wie retinale (6% bis 8%) oder choroidale Blutungen (22% bis 28%), Schmerzen (7% bis 11%) und verringerte Sehschärfe (7% bis 10%) treten in allen Behandlungsgruppen – und damit unter beiden Mitteln – in vergleichbarem Umfang auf. Endophthalmitis wird bei sechs Patienten (je drei unter Aflibercept bzw. Ranibizumab) berichtet. Ein erhöhter intraokulärer Druck (routinemäßige Messungen) tritt unter Aflibercept numerisch seltener auf (5,2% versus 6,9%). In den Zulassungsstudien kommen auch nichtokuläre unerwünschte Ereignisse in allen Gruppen ähnlich häufig vor.2 Im Bewertungsbericht der EMA1 wird jedoch bei Berücksichtigung aller Daten auf eine größere Zahl arterieller thromboembolischer Ereignisse unter Aflibercept hingewiesen (3,2% vs. 1,8%). Zehn transitorische ischämische Attacken werden unter Aflibercept beobachtet, keine unter Ranibizumab (0,5% vs. 0%). Zerebrovaskuläre Ereignisse insgesamt treten ab einem Alter von 65 Jahren häufiger unter Aflibercept auf, insbesondere bei den sehr alten Patienten über 85 Jahren (7,1% der Patienten vs. 1,1% unter Ranibizumab).1 Diese Altersgruppe macht immerhin 15% der Studienpopulation aus. Nach Ansicht der EMA können trotz der geringen Serumspiegel nach intravitrealer Injektion systemische Effekte nicht ausgeschlossen werden.
KOSTEN: Eine Durchstechflasche mit 4 mg Aflibercept, von der 2 mg entnommen werden (der Rest soll verworfen werden), kostet 1.136,03 € und damit 10% weniger als eine Durchstechflasche Ranibizumab (1.262,77 €), aus der 0,5 mg entnommen werden. Nur wenn die in den VIEW-Studien praktizierten Dosierungsintervalle zu Grunde gelegt werden, ergibt sich im ersten Behandlungsjahr für das zugelassene Aflibercept-Regime (7 Injektionen: 7.950 €) eine Kostenersparnis von 48% gegenüber Ranibizumab (12 Injektionen: 15.150 €). Nach den derzeitigen Empfehlungen zu bedarfsadaptierter Therapie auch mit Ranibizumab sind hingegen allenfalls geringe Einsparungen zu erwarten: Bei befundadaptierter Behandlung wurden z.B. in der CATT-Studie ebenfalls im Mittel nur sieben Injektionen mit 0,5 mg Ranibizumab im ersten Jahr gegeben. Die Arzneimittelkosten liegen für beide Mittel um ein Vielfaches über denen des off label verwendeten Bevacizumab (siehe Kasten).
Mit Aflibercept (EYLEA) ist ein weiterer VEGF-Hemmer zur intravitrealen Behandlung der feuchten Makuladegeneration auf dem Markt. Im direkten Vergleich mit Ranibizumab (LUCENTIS) ergeben sich in den Zulassungsstudien nach einem Jahr keine Wirksamkeitsunterschiede.
Die aus den Studien abgeleitete geringere Injektionsfrequenz im ersten Jahr (7 versus 12 Injektionen in VIEW) spielt in der Praxis keine Rolle, da dort Ranibizumab befundadaptiert injiziert wird.
Als Risikosignal erachten wir die im europäischen Bewertungsbericht errechneten häufigeren zerebrovaskulären Ereignisse im Vergleich zu Ranibizumab, insbesondere im sehr hohen Lebensalter.
Vergleiche mit dem off label verwendeten, deutlich preisgünstigeren Bevacizumab (AVASTIN) fehlen.
Einen Stellenwert für Aflibercept sehen wir derzeit nicht. Von den zugelassenen VEGF-Hemmern erachten wir bedarfsadaptiert injiziertes Ranibizumab als Mittel der Wahl. Wir halten daneben nach wie vor die Off-label-Anwendung von Bevacizumab für eine akzeptable Option.
| (R =randomisierte Studie) | |
| 1 | EMA: Europ. Beurteilungsbericht (EPAR) EYLEA, Stand 20. Sep. 2012 |
| R 2 | HEIER, J.S. et al. : Ophthalmology 2012; 119: 2537-48 |
| R 3 | GRAGOUDAS, E.S. et al.: N. Engl. J. Med. 2004; 351: 2805-16 |
| 4 | Dt. Ophthalmol. Ges., Retinolog. Ges. und Berufsverb. der Augenärzte Deutschl.: Die Anti-VEGF-Therapie bei der neovaskulären altersabhängigen Makuladegeneration: Therapeutische Strategien, Stand Dez. 2012 http://cms.augeninfo.de/fileadmin/stellungnahmen /Anti-VEGF-Therapie_bei_der_neovask_Therapeut_Strategie.pdf |
| R 5 | CATT Research Group: N. Engl. J. Med. 2011; 364: 1897-908 |
| R 6 | CATT Research Group: Ophthalmology 2012; 119: 1388-98 |
| R 7 | IVAN Study Investigators: Ophthalmology 2012; 119: 1399-411 |
| R 8 | KREBS, I. et al.: Br. J. Ophthalmology 2013; epub 3. Jan. 2013 |
| R 9 | BROWN, D.M. et al.: N. Engl. J. Med. 2006; 355: 1432-44 |
| R 10 | BROWN, D.M. et al: Ophthalmology 2009; 116: 57-65 |
| R 11 | ROSENFELD, P.J. et al.: N. Engl. J. Med. 2006; 355: 1419-31 |
| R 12 | SCHMIDT-ERFURTH, V. et al.: Ophthalmology 2011; 118: 831-98 |
| 13 | Novartis: Fachinformation LUCENTIS, Stand Juli 2012 |
| * | PIGF: Placental growth factor, gehört zur Familie der VEGF |
| ** | Erläuterung der Studien-Akronyme siehe *-Text in Tabelle |
| *** | Lesetafel, die für die Early Treatment Diabetic Retinopathy Study (ETDRS) insbesondere für Menschen mit niedrigen Visuswerten entwickelt wurde |
| **** | NEI VFQ-25 = National Eye Institute Visual Function Questionnaire-25 |
© 2013 arznei-telegramm, publiziert am 15. Februar 2013
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
