INSULIN DEGLUDEC (TRESIBA) BEI DIABETES MELLITUS
Etwas überraschend kam Anfang Mai das neue langwirkende Insulinanalogon Degludec (TRESIBA) für erwachsene Patienten mit Diabetes mellitus in Deutschland auf den Markt.1 Bisher schien der Hersteller von den Erfolgschancen seines Produktes nicht recht überzeugt gewesen zu sein: Noch im August 2013 wurde die frühe Nutzenbewertung nach dem AMNOG als zu großes Risiko für die Preisgestaltung in Deutschland angesehen (vgl. a-t 2014; 45: 14).2 Die europäische Arzneimittelbehörde EMA hat die Zulassung für TRESIBA und für das noch nicht in den Handel gebrachte Insulingemisch Degludec/Aspart (RYZODEG) bereits im Januar 2013 erteilt. Die US-amerikanische FDA verwehrte dem Insulinanalogon hingegen wegen kardiovaskulärer Risikosignale die Zulassung und fordert zunächst weitere Studien.3
Eine Besonderheit ist die erstmalige Einführung eines Insulin-Pens mit 200 E/ml, um mit einer Injektion hohe Insulindosierungen zu ermöglichen.
EIGENSCHAFTEN: Das gentechnisch produzierte Insulin degludec unterscheidet sich vom menschlichen Molekül durch Eliminierung der Aminosäure Threonin an Position 30 der B-Kette (B30) und Anbindung einer C16-Fettsäure an Lysin in Position B29. Dadurch bildet Degludec nach subkutaner Injektion Multi-Hexamere, die sich verzögert lösen und eine langanhaltende gleichmäßige Freisetzung ermöglichen. Degludec ist das am längsten wirkende Insulinanalogon mit einer Halbwertszeit von 25 Stunden und einer Wirkdauer von über 42 Stunden. Im Vergleich zu Insulin glargin, das im Studienprogramm als Hauptvergleich herangezogen wurde, ist die Konzentrations-Zeitkurve flacher, und es kommt später zu einem "peak" (nach ca. 12 versus ca. 6 Stunden). Ein Steady-State wird bei täglicher Injektion nach zwei bis drei Tagen erreicht.4,5
ÄQUIVALENZDOSIERUNG: Eine Einheit Degludec entspricht in seiner blutzuckersenkenden Wirksamkeit einer Einheit Humaninsulin. Die Umstellung von anderen Basalinsulinen ist laut Hersteller im Verhältnis 1 : 1 möglich.1 Die einmal tägliche Anwendung ist nicht zu einem festen Zeitpunkt notwendig, jedoch sollen mindestens acht Stunden zwischen den Injektionen liegen.1 Achtung: Um das Risiko von Dosierungsfehlern zu verringern, ist bei Verordnung des Pens mit 200 E/ml eine besondere Schulung der Patienten erforderlich.1,6
KLINISCHE WIRKSAMKEIT: Die europäische Zulassung beruht auf den Daten von neun offen durchgeführten verumkontrollierten Phase-III-Studien mit 6.544 Patienten über 26 oder 52 Wochen.4,7-13 Drei der Arbeiten wurden bei Typ-1-Diabetes (Basis-Bolus-Therapie mit Insulin aspart [NOVORAPID] als kurzwirkendem Insulin) durchgeführt, sechs Studien bei Typ-2-Diabetes (Basis-Bolus-Therapie mit Aspart oder Kombination mit oralen Antidiabetika). In sieben Studien wird Degludec mit Insulin glargin (LANTUS) verglichen, in einer mit Insulin detemir (LEVEMIR) und in einer weiteren mit dem Dipeptidylpeptidase (DPP)-4-Hemmer Sitagliptin (JANUVIA, XELEVIA). Vergleiche mit NPH-Insulin (HUMINSULIN BASAL u.a.) liegen nicht vor. Primärer Endpunkt ist jeweils die Senkung des HbA1c, wobei bis auf den Vergleich mit Sitagliptin alle Arbeiten als Nichtunterlegenheitsstudien angelegt sind. Das HbA1c sinkt im Verlauf bei Typ-1-Diabetes um 0,4% bis 0,7 % und bei Typ-2-Diabetes um 1,1% bis 1,6% ohne wesentliche Unterschiede zwischen den Behandlungsgruppen. Die Kriterien der Nichtunterlegenheit* werden jeweils erfüllt. Die deutliche Senkung des HbA1c bei Typ-2-Diabetes kommt durch die übermäßig streng gesetzten Therapieziele ("treat-to-target") zu Stande (Nüchternglukose unter 90 mg/dl). Im Vergleich zu Sitagliptin sinkt das HbA1c unter Degludec statistisch signifikant stärker (-1,52% vs. 1,09%).10
| * | Berechnet wird die Differenz der HbA1c-Senkung zwischen den Behandlungsgruppen und das dazugehörige 95%-Konfidenzintervall (CI). Nichtunterlegenheit gilt als bestätigt, wenn die obere Grenze des 95% CI nicht größer als 0,4% ist, Degludec also im schlechtesten Fall das HbA1c um 0,4% weniger senkt als das Vergleichsmittel. |
STÖRWIRKUNGEN: Dem Hersteller war in erster Linie daran gelegen, eine Überlegenheit des neuen Insulins gegenüber anderen Basalinsulinen im Hinblick auf Hypoglykämien nachzuweisen. In einer prospektiv geplanten Metaanalyse der Zulassungsstudien zum Hypoglykämierisiko im Vergleich zu Glargin finden sich jedoch keine konsistenten Vorteile für Degludec: Schwere Hypoglykämien** treten unter beiden Insulinen gleich häufig auf (Rate Ratio [RR] 0,98). Messtechnisch bestätigte Hypoglykämien insgesamt (Glukose <56 mg/dl) sind unter Degludec seltener (RR 0,91, 95% Konfidenzintervall [CI] 0,83-0,99). Der Vorteil wird aber nur bei Typ-2-Diabetes gesehen, dessen strikte Stoffwechselführung so nicht mehr allgemein empfohlen wird.14 Numerisch ist die Zahl bestätigter Hypoglykämien bei Typ-1-Diabetes unter Degludec sogar höher.4,5 Von den "bestätigten" Hypoglykämien verläuft zudem bei Typ-1-Diabetes ein Drittel, bei Typ-2-Diabetes sogar etwas mehr als die Hälfte asymptomatisch.5 Nur 0,27% der bestätigten Hypoglykämien bei Typ-1-Diabetes und 0,08% bei Typ-2-Diabetes sind als schwer eingestuft.5 Wird, wie von der FDA vorgerechnet, der spezifischere Endpunkt der "symptomatischen messtechnisch bestätigten" Hypoglykämien ausgewertet, ist kein Vorteil mehr für Degludec zu sehen.5
| ** | Schwere Hypoglykämien sind definiert als Unterzuckerungen, bei denen Hilfe durch Dritte (z.B. Gabe von Glukose) notwendig wird. |
Bestätigte nächtliche Hypoglykämien (zwischen 0:00 Uhr und 6:00 Uhr) treten bei beiden Diabetesformen unter Degludec seltener auf als unter den Vergleichsinsulinen. Nach einer Analyse der FDA verschwindet dieser Vorteil jedoch auch hier, wenn der nächtliche Beobachtungszeitraum um zwei Stunden verlängert wird (0:00 Uhr bis 8:00 Uhr).5 Die Berechnung der FDA ist begründet: Degludec wird in einem Teil der Studien - anders als Glargin - zu einem festen Zeitpunkt abends gespritzt und hat seinen Wirkungspeak nach 12 Stunden. Hypoglykämien werden daher möglicherweise in die Morgenstunden nach 6 Uhr "verschoben".
Lokale Reaktionen am Injektionsort und Lipodystrophien werden unter Degludec in beiden Konzentrationen nicht häufiger als unter den Vergleichsinsulinen gesehen.4
Krebserkrankungen treten unter Insulin glargin und degludec gleich häufig auf (0,5%). Nach experimentellen Daten ist die Affinität von Degludec für den Insulin-growth-factor-Rezeptor (IGF1-R) geringer als die von Humaninsulin, sodass die EMA von einer nicht gesteigerten Mutagenität des neuen Insulins ausgeht.4
Dass die amerikanische FDA trotz des positiven Votums (8 : 4) eines externen Beratergremiums3,15 die Zulassung versagte, liegt an behördeneigenen Auswertungen*** der von der Firma vorgelegten Unterlagen, in denen ein konsistentes Risikosignal für kardiovaskuläre Ereignisse (kardiovaskulärer Todesfall, nichttödlicher Herzinfarkt oder nichttödlicher Insult) gesehen wird. Auf der Basis der Sicherheitsdaten von 9.255 Patienten (Beobachtung über 7.716 Patientenjahre) wird ein signifikant erhöhtes Risiko errechnet (Hazard Ratio 1,67; 95% CI 1,01-2,75). Die Analyse beruht auf 91 Ereignissen (Degludec: 70/5.794 [1,2%], Vergleichsmittel: 21/3.461 [0,6%]; Number needed to Harm = 167).5 Das Risikosignal erscheint bedeutsam, da die kardiovaskulären Ereignisse nach strengen methodischen Kriterien erhoben wurden und zudem Patienten mit kardiovaskulären Ereignissen innerhalb der letzten sechs Monate von den Studien ausgeschlossen waren. Risikopatienten sind daher möglicherweise stärker gefährdet, als es in der Studienpopulation zum Ausdruck kommt. Von einem Diabetesmittel wird ein Beitrag zur Verringerung des vaskulären Risikos erwartet, Signale in die entgegengesetzte Richtung sind ernst zu nehmen. Ein Hinweis auf die Sicherheitsbedenken fehlt in der deutschen Fachinformation1 vollständig, obwohl auch die EMA in ihrem Bewertungsbericht numerisch erhöhte Gefäßereignisse unter Degludec dokumentiert. Die europäische Behörde fordert hierzu noch nicht einmal Sicherheitsdaten aus Postmarketingstudien.4
| *** | Die FDA berücksichtigt in ihrer Berechnung die etablierte Definition des kardiovaskulären Sammelendpunkts "MACE" - kardiovaskulärer Tod, nichttödlicher Herzinfarkt, nichttödlicher Insult -, während der Hersteller in seiner (nichtsignifikanten) Analyse zusätzlich instabile Angina pectoris einbezieht. |
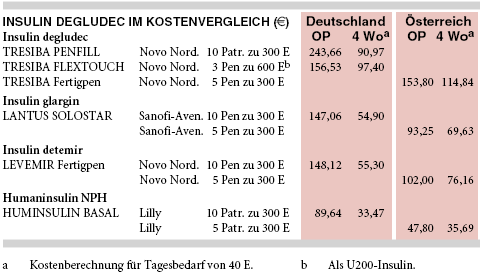
KOSTEN: Im Vergleich zu NPH-Insulin (HUMINSULIN BASAL u.a.) ist Degludec (TRESIBA) knapp dreimal so teuer (bei vier Wochen lang täglich 40 E: 91 € bzw. 97 € versus 33 €). Gegenüber den bereits auf dem Markt befindlichen langwirkenden Insulinanaloga Detemir (LEVEMIR) und Glargin (LANTUS) - jeweils 55 € bei vier Wochen 40 E/Tag - müsste gemäß Vergleich der Listenpreise ungefähr das 1,7-Fache aufgewendet werden. Die bislang zugelassenen Insulinanaloga dürfen jedoch zu Lasten der Krankenkassen nur verordnet werden, wenn keine Mehrkosten gegenüber Humaninsulin entstehen, was aufgrund der hohen Listenpreise nur mit Rabattverträgen gelingt. Die realen Kosten sind daher nicht transparent.
Mit Insulin degludec (TRESIBA) ist ein neues langwirkendes Insulinanalogon im Handel, das für Erwachsene mit Diabetes mellitus Typ 1 und Typ 2 zugelassen ist. Erstmals gelangt mit TRESIBA auch eine höhere Insulinkonzentration (200 E/ml) auf den europäischen Markt. Aufgrund des Risikos von Dosierungsfehlern erfordert die Verwendung dieser Zubereitung eine besondere Schulung der Patienten.
In den Zulassungsstudien lässt sich kein Vorteil hinsichtlich der Stoffwechselführung (HbA1c) gegenüber dem in den meisten Studien verwendeten Insulin glargin (LANTUS) erkennen. Prüfungen gegen das als Standard geltende NPH-Humaninsulin fehlen.
Schwere oder symptomatische Hypoglykämien treten unter Degludec nicht seltener auf als unter Glargin oder Detemir (LEVEMIR). Geringe Vorteile bei messtechnisch gesicherten Hypoglykämien sieht man nur bei Diabetes mellitus Typ 2. Ein erheblicher Teil dieser Hypoglykämien ist jedoch asymptomatisch, und nur ein Bruchteil der Ereignisse verläuft schwer.
Die vorliegenden Daten lassen keinen relevanten therapeutischen Fortschritt gegenüber anderen langwirkenden Insulinen erkennen. Die US-amerikanische Arzneimittelbehörde FDA versagte dem Mittel die Zulassung, da sie in eigenen Analysen einen Anstieg kardiovaskulärer Ereignisse unter Degludec gegenüber den Vergleichsmitteln errechnet. Die Zulassung durch die EMA ohne Hinweis auf dieses Risikosignal in den Produktinformationen erachten wir als fahrlässig im Sinne der Patientensicherheit. Wir raten von der Anwendung des überteuerten Insulins ab.
| (R = randomisierte Studie) | |
| 1 | Novo Nordisk: Fachinformation TRESIBA, Stand Mai 2014 |
| 2 | BRUCE, F.: scripnews vom 30. Aug. 2013: Seite 7 |
| 3 | Novo Nordisk: Pressemitteilung vom 10. Febr. 2013 http://www.a-turl.de/?k=lapp |
| 4 | EMA: Europ. Beurteilungsbericht (EPAR) TRESIBA, Sept. 2012 http://www.a-turl.de/?k=amml |
| 5 | FDA: Briefing Document: Insulin Degludec and Insulin Degludec/Aspart, Endocrinologic and Metabolic Drugs Advisory Committee Meeting, 8. Nov. 2012; http://www.a-turl.de/?k=omar |
| 6 | MHRA: Drug Safety Update 2013; 6 (9): A1; http://www.a-turl.de/?k=oxhe |
| R 7 | HELLER, S. et al.: Lancet 2012; 379: 1489-97 |
| R 8 | GARBER, A. J. et al.: Lancet 2012; 379: 1498-507 |
| R 9 | ZINMAN, B. et al.: Diabetes Care 2012; 35: 2464-71 |
| R 10 | PHILIS-TSIMIKAS, A. et al.: Diabetes Obes. Metab. 2013; 15: 760-6 |
| R 11 | ONISHI, Y.: J. Diabetes Invest. 2013; 4: 605-12 |
| R 12 | MENEGHINI, L. et al.: Diabetes Care 2013; 36: 858-64 |
| R 13 | GOUGH, S.C.L. et al. : Diabetes Care 2013; 36: 2536-42 |
| 14 | Nationale Versorgungsleitlinie Therapie des Typ-2-Diabetes, Zusammenfassung Stand Okt. 2013
zu finden unter: http://www.a-turl.de/?k=haud |
| 15 | MOSKOWITZ, D.: US FDA advisers back Novo Nordisk genetic insulins, despite worries, scripintelligence vom 9. Nov. 2012 |
© 2014 arznei-telegramm, publiziert am 6. Juni 2014
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
