PIRIBEDIL (CLARIUM) BEI M. PARKINSON
"Obenauf bei PARKINSON. Geht clar" wirbt die Firma Desitin für den nicht-ergolinen Dopaminagonisten Piribedil (CLARIUM).1 Der mehr als 30 Jahre lang zur Durchblutungsförderung (TRIVASTAL) verwendete Piperazinabkömmling ist jetzt in Deutschland nur noch unter dem Warenzeichen CLARIUM und nur zur Behandlung des M. PARKINSON erhältlich.
Als einer der ältesten Dopaminagonisten wurde Piribedil bereits in den 1970er Jahren als Antiparkinsonmittel erforscht. Nach klinischer Beobachtung in Kleinststudien wurde am ehesten Tremor verringert, die Wirkung auf PARKINSON-Symptome insgesamt aber teilweise als ineffektiv eingestuft.2,3 Ausgeprägte psychiatrische Störwirkungen führten damals zur Einstellung einer geplanten größeren Studie in dieser Indikation.4
EIGENSCHAFTEN: Piribedil ist ein Dopaminagonist mit vorwiegender Wirkung auf die Rezeptor-Subtypen D2/D3 und zusätzlichen antagonistischen Eigenschaften an alpha-2-adrenergen Rezeptoren.

KLINISCHE WIRKSAMKEIT: Nur zwei der drei zulassungsrelevanten Phase-III-Studien7-9 sind veröffentlicht (REGAIN*7, CONTROL*8). An den drei Studien nehmen insgesamt 1.1036 im Mittel 62- beziehungsweise 65-jährige Patienten teil, die höchstens moderat, überwiegend jedoch nur geringgradig erkrankt sind (bis Grad III nach HOEHN und YAHR). Wegen der unter Dopaminagonisten zu erwartenden gastrointestinalen Störwirkungen nehmen sie grundsätzlich den Dopaminantagonisten Domperidon (MOTILIUM, Generika) ein. Dieser kann jedoch mit verschiedenen PARKINSON-Mitteln Wechselwirkungen eingehen und zudem selbst extrapyramidalmotorische Symptome verursachen.
| * | REGAIN = Early Treatment of Idiopathic PD With the Dopaminergic Agonist Trivastal 50 Retard in Monotherapy; CONTROL = Akronym ohne Erklärung |
In der zweijährigen doppelblinden, plazebokontrollierten REGAIN-Studie wird die frühe Monotherapie mit Piribedil untersucht: Nach einer einmonatigen Plazebo-run-in-Phase kann der Dopaminagonist über die jetzt zugelassene maximale Dosis von 250 mg hinaus bis auf täglich 300 mg aufdosiert werden (durchschnittlich 240 mg). Primär wird die Veränderung der mit der UPDRS-III-Skala** erfassten Motorik (Ausgangswerte unter Piribedil durchschnittlich 26, unter Plazebo 23 von insgesamt 56 Punkten) nach sechsmonatiger Einnahme geprüft. Sekundär wird der Anteil der Patienten mit mindestens 30%iger Verbesserung der Motorik (Responder) erfasst. Piribedil senkt den UPDRS-Wert signifikant im Mittel um 4,9 Punkte, unter Plazebo nimmt er dagegen um 2,6 Punkte zu. 42% der Piribedilanwender und 14% unter Plazebo erfüllen die Responsekriterien. Das bei nicht ausreichender Wirksamkeit erst nach dem 42. Tag notfalls zusätzlich erlaubte Levodopa benötigen 40% unter Plazebo und 17% unter Piribedil.7
| ** | UPDRS-III = Auf Erfassung der Motorik ausgerichteter Teil der Unified Parkinson Disease Rating Scale, item 18-31, jeweils 0-4 Punkte, Grundversion maximal 56 Punkte |
In der CONTROL-Studie nehmen Patienten, die bereits seit mindestens drei Monaten und längstens fünf Jahren auf weniger als 600 mg Levodopa und Dekarboxylasehemmer (z.B. MADOPAR, Generika) stabil eingestellt sind und eine Therapieanpassung benötigen, nach einer Plazebo-run-in-Phase täglich zusätzlich entweder bis zu 150 mg Piribedil oder bis zu 25 mg Bromocriptin (PRAVIDEL, Generika) ein.8 Piribedil ist Bromocriptin nach zwölf Monaten nicht überlegen: Unter beiden Dopaminagonisten nimmt die mit dem UPDRS-III gemessene motorische Einschränkung von eingangs im Mittel 24 Punkten um 8 Punkte ab. Auch der Anteil derjenigen, die auf das Mittel ansprechen (Responder, 58% vs. 55%), unterscheidet sich nicht.8 In der methodisch unbefriedigenden Untersuchung wird Bromocriptin in nur vier Wochen sehr schnell aufdosiert. Trotzdem brechen unter dem alten Dopaminagonisten 15%, unter Piribedil 20% wegen Störwirkungen ab. Insgesamt beendet knapp jeder Vierte die Studie vorzeitig.8
Publizierte Langzeitdaten aus kontrollierten Studien zum Erhalt früher Therapieeffekte, zur Dyskinesierate und zur Sicherheit bei mehrjähriger Anwendung fehlen sowohl für die Monotherapie als auch für die Kombination mit Levodopa.
STÖRWIRKUNGEN: Gastrointestinale Nebenwirkungen unter Piribedil wie Übelkeit (trotz Einnahme von Domperidon bei bis zu 17%; Bromocriptin 19%)8 sowie Hypotonie (8%)8 und periphere Ödeme (5%)8 entsprechen dem bekannten Störwirkungsprofil von Dopaminagonisten. Halluzinationen und Somnolenz kommen häufiger vor als unter Bromocriptin (8% versus 3%, 7% vs. 4%).8 Schlafattacken (a-t 2000; 31: 56), Spielsucht und Hypersexualität (a-t 2005; 36: 84) sind auch unter Piribedil beschrieben.6,10 Relevante und häufige Nebenwirkungen werden in der Fachinformation6 nicht genannt, beispielsweise Hypertonie (bis 10%)7, Angst (bis 7%)7, Schlaflosigkeit (bis 7%)7 und Dyskinesien in Kombination mit Levodopa (3%; Bromocriptin 5%)8.
Zwei Patienten der CONTROL-Studie sterben: Ein Piribedilanwender an Herzinfarkt, ein zweiter, der eine psychotische Episode entwickelt, an Herzversagen, nachdem er Piribedil abgesetzt und ein Neuroleptikum eingenommen hat.
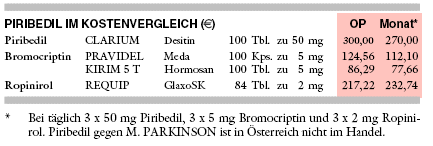
KOSTEN: Bezogen auf eine Tagesdosis von 150 mg ist für Piribedil (CLARIUM) mit monatlich 270 € das 3,5fache eines Bromocriptin-Nachfolgepräparates (KIRIM, 78 € für 15 mg täglich) und 16% mehr als für Ropinirol (REQUIP; 233 € für 6 mg täglich) aufzuwenden.
Der noch bis vor wenigen Monaten als TRIVASTAL zur Durchblutungsförderung angebotene Dopaminagonist Piribedil (CLARIUM) verringert nach hochdosierter früher Monotherapie über sechs Monate bei vorwiegend geringgradig Betroffenen die motorische PARKINSON-Symptomatik im Vergleich mit Plazebo statistisch signifikant.
Zusätzlich zu Levodopa eingenommen ist Piribedil dem Dopaminagonisten Bromocriptin (PRAVIDEL, Generika) nach einem Jahr nicht überlegen.
Psychiatrische Störwirkungen wie Halluzinationen und Somnolenz kommen in Kombination mit Levodopa häufiger vor als unter einem Standardmittel wie Bromocriptin. Zudem ist nicht nur mit Hypotonie, sondern oft auch mit Hypertonie zu rechnen.
Aufgrund der nicht erkennbaren Vorteile, fehlender kontrollierter Langzeitstudien und der erheblichen Kosten sehen wir keine Indikation für das Me-too-Präparat.
| (R = randomisierte Studie) | ||
| 1 | Desitin: Werbung zu CLARIUM, Nervenarzt 2007; 78, Heft 11 | |
| 2 | McLELLAN, D.L. et al.: Acta Neurol. Scand. 1975; 51: 74-82 | |
| 3 | LIEBERMAN, A.N. et al.: Adv. Neurol. 1975; 9: 339-407 | |
| 4 | ENGEL, J. et al.: Europ. J. Clin. Pharmacol. 1975; 8: 223-6 | |
| R | 5 | MONTASTRUC, J.-L. et al.: Mov. Disord. 1999; 14: 336-41 |
| 6 | ENGEL, J. et al.: Europ. J. Clin. Pharmacol. 1975; 8: 223-6 | |
| R | 7 | RASCOL, O. et al.: Mov. Disord. 2006; 21: 2110-5 |
| R | 8 | CASTRO-CALDAS, A. et al.: Mov. Disord. 2006; 21: 500-9 |
| 9 | KWIECINSKI, H. et al.: Neurology 2002; 58 (Suppl. 3): A163 | |
| 10 | TAN, E.K.: Fund. & Clin. Pharmacol. 2003; 17: 117-9 |
© 2007 arznei-telegramm, publiziert am 7. Dezember 2007
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
