PROTEASEHEMMER TELAPREVIR (INCIVO) GEGEN CHRONISCHE HEPATITIS C
Kurz nach Markteinführung von Boceprevir (VICTRELIS; a-t 2011; 42: 77-9) ist inzwischen mit Telaprevir (INCIVO) auch der zweite HCV-Proteasehemmer zur Therapie Erwachsener mit chronischer Hepatitis C vom Genotyp 1 im Handel. Wie Boceprevir muss Telaprevir mit der bisherigen Standardtherapie der chronischen Hepatitis C, Peginterferon alfa (2a: PEGASYS, 2b: PEGINTRON) plus Ribavirin (COPEGUS, REBETOL), kombiniert werden.1
EIGENSCHAFTEN: Wie Boceprevir hemmt Telaprevir die für die virale Replikation des HC-Virus erforderliche NS*-3/4A-Protease. Auch Telaprevir darf wegen rascher Resistenzentwicklung nicht als Monotherapie verwendet werden. Zwischen den beiden HCV-Proteasehemmern scheint Kreuzresistenz zu bestehen.2 Dagegen sollen nach Einschätzung der US-amerikanischen Arzneimittelbehörde FDA Kreuzaktivitäten und Kreuzresistenzen mit den gegen HIV verwendeten Proteasehemmern nicht zu erwarten sein.3
| * | NS = Non-Structural |

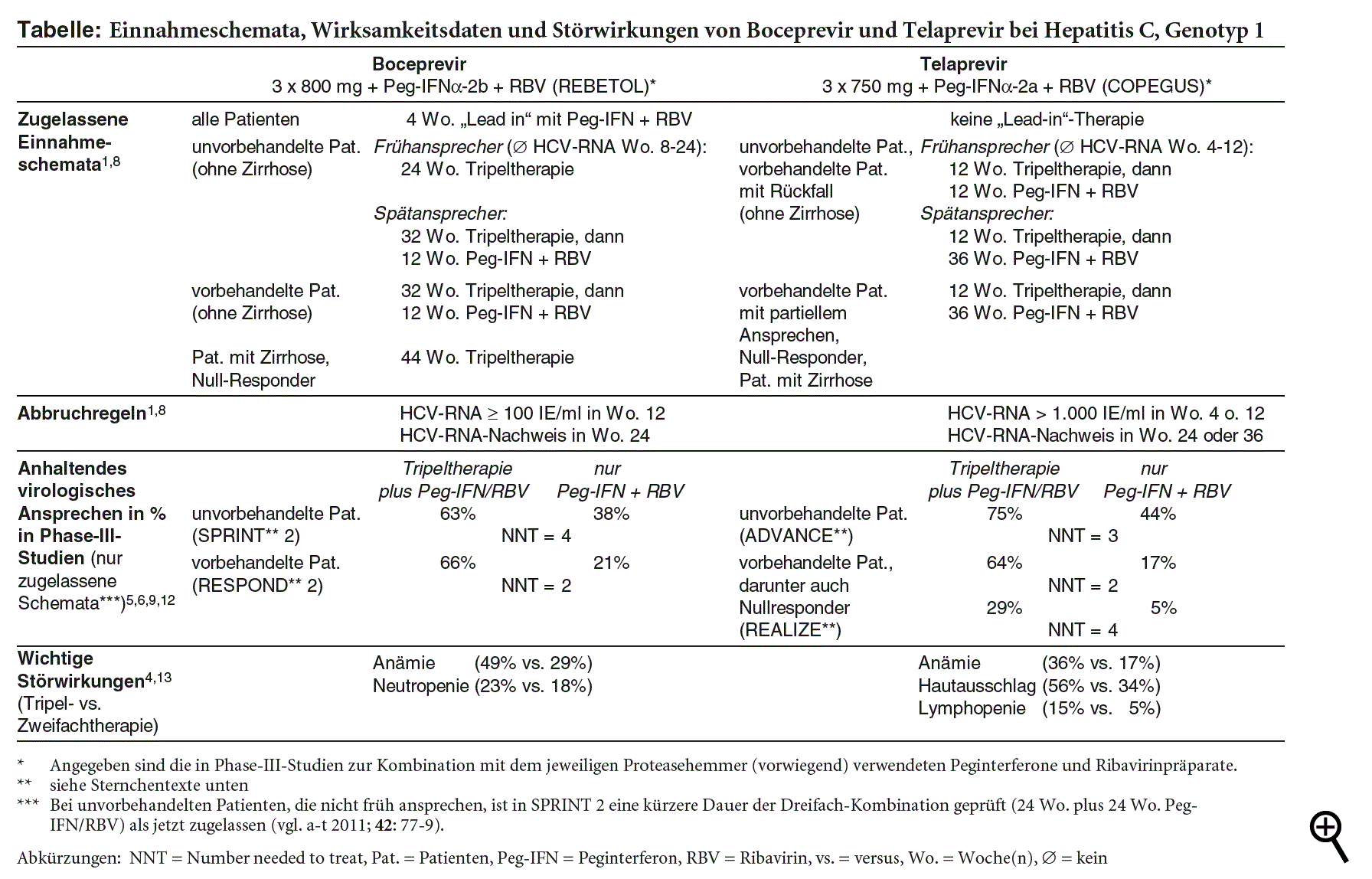
KLINISCHE WIRKSAMKEIT: Direkte Vergleichsstudien zwischen Boceprevir und Telaprevir fehlen. Im indirekten Vergleich führen die beiden für Telaprevir zugelassenen Therapieschemata, ein am Ansprechen orientiertes Schema ("response guided") bei unvorbehandelten Patienten (ADVANCE**-Studie)5 sowie ein festes Langzeitschema bei vorbehandelten Patienten (REALIZE**-Studie),6 zu ähnlich hohen Erfolgsraten wie die entsprechenden Schemata mit Boceprevir (vgl. Tabelle). Primäres Zielkriterium ist auch in den Telaprevir-Studien ein anhaltendes virologisches Ansprechen, definiert als nicht nachweisbare HCV-RNA 24 Wochen nach geplanter Beendigung der Therapie.5,6 Anhaltendes virologisches Ansprechen gilt als valider Surrogatparameter für die Verringerung von Komplikationen der chronischen Hepatitis C einschließlich Zirrhose, Leberzellkarzinom und Sterblichkeit.7
| ** | ADVANCE und REALIZE = keine Erklärung für Akronyme gefunden SPRINT = Serine Protease Inhibitor Therapy |
Telaprevir wird in allen Phase-III-Studien mit Peginterferon (Peg-IFN) alfa-2a kombiniert, Boceprevir vorwiegend mit Peg-IFN alfa-2b. Daten zur Kombination von Telaprevir mit Peg-IFN alfa-2b bei vorbehandelten Patienten fehlen und sind bei unvorbehandelten sehr begrenzt: Virale Durchbrüche scheinen unter dieser Kombination häufiger vorzukommen.2 Umgekehrt scheint die Kombination von Boceprevir mit Peg-IFN alfa-2a bei ähnlicher Wirksamkeit toxischer zu sein als die mit 2b (mehr Neutropenien).8 Beide Proteasehemmer sollten unseres Erachtens daher mit dem Peginterferon kombiniert werden, mit dem sie in Phase-III-Studien (vorwiegend) geprüft wurden.
Telaprevir wird im Unterschied zu Boceprevir jeweils nur zwölf Wochen lang eingenommen. Eine "Lead-in"-Behandlung mit Peg-IFN plus Ribavirin über vier Wochen, wie sie für Boceprevir vorgeschrieben ist, entfällt: Ein Schema mit Lead-in-Therapie bietet im direkten Vergleich mit einem ohne keinen klaren Vorteil im Hinblick auf virologisches Ansprechen, Therapieversagen oder Rückfallrate.2,6 Bei den Frühansprechern unter "Response-guided"-Therapie ist wegen der wegfallenden Lead-in-Phase auch die Gesamtdauer der Therapie vier Wochen kürzer als unter Boceprevir. Bei allen anderen Patienten dauert die Therapie auch unter Telaprevir insgesamt 48 Wochen.
Wie bei Boceprevir fehlen auch bei Telaprevir aussagekräftige Daten zu Patienten mit HIV- oder Hepatitis-B-Koinfektion. Ein Unterschied in der klinischen Prüfung der beiden HCV-Proteasehemmer betrifft Patienten, die auf eine Vorbehandlung mit Standardtherapie gar nicht angesprochen haben (so genannte Null-Responder). Während diese von der entsprechenden Boceprevir-Studie (RESPOND*** 2) ausgeschlossen sind,9 haben sie an der REALIZE-Studie mit Telaprevir teilgenommen und bilden hier eine prädefinierte Subgruppe, nach der auch die Randomisierung stratifiziert wurde. Bei insgesamt deutlich geringeren Erfolgsraten steigert Telaprevir auch in dieser Subgruppe die Häufigkeit eines anhaltenden virologischen Ansprechens signifikant und relevant (vgl. Tabelle).6 Für Patienten, die auf Standardtherapie vollständig angesprochen, dann aber einen Rückfall erlitten haben, ist in Verbindung mit Telaprevir eine Response-geleitete Therapie zugelassen, obwohl dies in Phase-III-Studien nicht geprüft wurde. Die Zulassung beruht auf Daten aus Phase-II-Studien und indirekten Vergleichen.2
| *** | RESPOND = Retreatment with HCV Serine Protease Inhibitor Boceprevir and Pegintron/Rebetol |
STÖRWIRKUNGEN: Im Vordergrund der Sicherheitsbedenken stehen Anämie und Hautreaktionen. Wie unter Boceprevir kommt es auch unter Telaprevir zu einer gegenüber Peg-IFN plus Ribavirin erhöhten Anämierate (36% versus 17%; Number needed to harm [NNH] = 5).2,4 Anders als in Boceprevir-Studien war die Anwendung von Erythropoetin-stimulierenden Wirkstoffen (ESA) zur Behandlung der Anämie nicht erlaubt. Nach Einschätzung der US-amerikanischen Arzneimittelbehörde FDA tragen ESA bei Anämie von Hepatitis-C-Patienten möglicherweise ein eigenes Sicherheitsrisiko, dessen Ausmaß nicht hinreichend bekannt ist.10 Die höheren Raten von Bilirubin- und Harnsäureanstiegen unter Telaprevir (41% bzw. 73% vs. 28% bzw. 29% unter Peg-IFN plus Ribavirin) hängen möglicherweise mit der durch den Proteasehemmer verstärkten Hämolyse zusammen.4,11 Wie Boceprevir erhöht Telaprevir das Thrombopenierisiko gegenüber Standardtherapie (schwere Thrombopenie 3% vs. 1%), nicht aber das Neutropenierisiko. Andererseits kommt es unter Telaprevir häufiger zu Lymphopenien (schwere Lymphopenie 15% vs. 5% unter Peg-IFN plus Ribavirin allein).4
Während Hautreaktionen kein auffälliges Risiko von Boceprevir darstellen, treten bei mehr als der Hälfte der Telapreviranwender häufig von Juckreiz begleitete Hautausschläge auf (56% vs. 34% unter Standardtherapie allein; NNH = 5). Hautausschlag mit Ausdehnung auf über 50% der Körperoberfläche betrifft 4,8% (Standardtherapie 0,4%). Bei 0,4% besteht Verdacht auf ein so genanntes DRESS****-Syndrom, bei dem Hautausschlag mit Eosinophilie und systemischen Symptomen sowie Beteiligung innerer Organe einhergeht. Selten (weniger als 0,1%) wird ein STEVENS-JOHNSON-Syndrom beobachtet.1,4 Unter Peg-IFN plus Ribavirin allein kommen schwerwiegende Hautreaktionen in den Telaprevir-Zulassungsstudien nicht vor.2 Patienten müssen über diese unerwünschten Wirkungen informiert sein. Leichter bis mittelgradiger Hautausschlag muss überwacht werden, bei schwerem Hautausschlag muss Telaprevir unverzüglich dauerhaft abgesetzt werden. Bei Verdacht auf bedrohliche Exantheme wie DRESS ist die gesamte Tripeltherapie unverzüglich zu beenden.1
| **** | DRESS = Drug Rash With Eosinophilia and Systemic Symptoms |
Magen-Darm-Störungen wie Übelkeit (39% vs. 28%) oder Durchfall (26% vs. 17%) kommen unter Telaprevir häufiger vor als unter Peg-IFN plus Ribavirin allein. Geschmacksstörungen nehmen ebenfalls zu (10% vs. 3%). Auffällig sind zudem häufige anorektale Beschwerden wie Juckreiz oder rektales Brennen (29% vs. 7%), die zwar selten schwerwiegend, aber störend sind. Ein ursächlicher Mechanismus ist nicht bekannt.4,11
KOSTEN: Ein Behandlungszyklus mit Telaprevir über zwölf Wochen (täglich 3 x 750 mg) kostet 36.463 € zuzüglich 11.860 € bzw. 23.720 € für 24 bzw. 48 Wochen Peg-IFN plus Ribavirin (RBV)*****. Die Kurzzeitbehandlung mit Telaprevir ist daher mit 48.323 € mehr als 10.000 € (28%) teurer als die entsprechende Therapie mit Boceprevir (37.831 €: 23.921 € für täglich 3 x 800 mg über 24 Wochen plus 13.910 € für 28 Wochen Peg-IFN plus RBV). Die Langzeitbehandlung mit Telaprevir (60.183 €) verteuert sich gegenüber Boceprevir (55.741 €: 31.894 € für 32 Wochen plus 23.847 € für 48 Wochen Peg-IFN plus RBV) um 4.442 € (8%). Bei Patienten mit Zirrhose und Null-Respondern kostet die Langzeittherapie mit Boceprevir allerdings 67.702 € (43.855 € für 44 Wochen Boceprevir plus 23.847 € für 48 Wochen Peg-IFN plus RBV). Das Therapieregime mit Telaprevir (60.183 €) kostet hier 7.519 € (11%) weniger.
| ***** | Preisangaben für Peg-IFN plus Ribavirin beziehen sich auf die Präparate, die mit dem jeweiligen Proteasehemmer in Phase-III-Studien (vorwiegend) geprüft wurden. |

Mit Telaprevir (INCIVO) gibt es jetzt den zweiten Proteasehemmer zur Therapie der chronischen Hepatitis C Genotyp 1 in Kombination mit Peginterferon alfa (2a: PEGASYS, 2b: PEGINTRON) plus Ribavirin (COPEGUS, REBETOL).
Telaprevir steigert die Rate des anhaltenden virologischen Ansprechens gegenüber Peginterferon plus Ribavirin allein signifikant und relevant.
Im indirekten Vergleich wirkt es ähnlich wie Boceprevir (VICTRELIS).
Wie Boceprevir steigert Telaprevir die Anämierate und die Häufigkeit von Thrombopenien, nicht hingegen die Neutropenierate, dafür aber die Lymphopenierate gegenüber Peginterferon und Ribavirin allein.
Anders als unter Boceprevir fallen unter Telaprevir häufige Hautausschläge auf, die auch schwer verlaufen können.
Die Tripeltherapie mit Telaprevir ist mit zwölf Wochen kürzer als die mit Boceprevir. Die Therapiedauer insgesamt verkürzt sich gegenüber der mit Boceprevir nur bei Frühansprechern um vier Wochen, bei allen anderen nicht.
Aussagekräftige Daten für Patienten mit HIV- oder Hepatitis-B-Koinfektion gibt es zu keinem der beiden Proteasehemmer.
Anders als Boceprevir ist Telaprevir auch bei so genannten Null-Respondern geprüft und scheint hier wirksam.
Zusatz von Telaprevir verursacht pro Therapiezyklus Mehrkosten von über 36.000 €. Die Mehrkosten liegen somit bei einem Teil der Patienten nochmals höher als die für Boceprevir.
Aufgrund des Störwirkungsspektrums mit auffälligen Hautreaktionen unter Telaprevir erscheint uns derzeit im Allgemeinen Boceprevir die bessere Wahl zu sein. Im Einzelfall kann aufgrund der Unterschiede in Anwendungsschemata und Störwirkungsprofil aber auch Telaprevir Vorrang haben. Telaprevir ist beim derzeitigen Kenntnisstand Mittel der Wahl bei Patienten, die auf eine Vortherapie mit Peginterferon und Ribavirin gar nicht angesprochen haben.
Beide HCV-Proteasehemmer sollten jeweils mit den Peginterferonen kombiniert werden, mit denen sie in Phase-III-Studien (vorwiegend) geprüft wurden.
| (R =randomisierte Studie) | |
| 1 | Janssen-Cilag: Fachinformation INCIVO, Stand Sept. 2011 |
| 2 | EMA: Europ. Beurteilungsber. (EPAR) INCIVO, Stand Juli 2011 http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/002313/WC500115532.pdf |
| 3 | FDA: Teleconference Briefing on Direct Acting Antivirals, VICTRELIS (boceprevir) and INCIVEK (telaprevir) transcript, 23. Mai 2011 http://www.fda.gov/ForConsumers/ByAudience/ForPatientAdvocates/ucm256753.htm |
| 4 | Vertex Pharmaceuticals: US-amerikanische Produktinformation INCIVEK, Stand Mai 2011 http://www.accessdata.fda.gov/drugsatfda_docs/label/2011/201917lbl.pdf |
| R 5 | JACOBSON, I.M. et al.: N. Engl. J. Med. 2011; 364: 2405-16 |
| R 6 | ZEUZEM, S. et al.: N. Engl. J. Med. 2011; 364: 2417-28 |
| 7 | FDA: Summary Review Telaprevir (INCIVEK), Stand Mai 2011; http://www.accessdata.fda.gov/drugsatfda_docs/nda/2011/201917 Orig1s000SumR.pdf |
| 8 | MSD: Fachinformation VICTRELIS, Stand Juli 2011 |
| R 9 | BACON, B.R. et al.: N. Engl. J. Med. 2011; 364: 1207-17 |
| 10 | FDA: Medical Review Boceprevir (VICTRELIS), Stand Apr. 2011 http://www.accessdata.fda.gov/drugsatfda_docs/nda/2011/202258Orig1s000MedR.pdf |
| 11 | FDA: Medical Review Telaprevir (INCIVEK), Stand Apr. 2011; http://www.accessdata.fda.gov/drugsatfda_docs/nda/2011/201917Orig1s000MedR.pdf |
| R 12 | POORDAD, B.R. et al.: N. Engl. J. Med. 2011; 364: 1195-206 |
| 13 | EMA: Europ. Beurteilungsbericht (EPAR) VICTRELIS, Stand Mai 2011 http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/002332/WC500109789.pdf |
© 2011 arznei-telegramm, publiziert am 2. Dezember 2011
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.