NEUE INDIKATIONEN FÜR FAKTOR-XA-HEMMSTOFF RIVAROXABAN (XARELTO)
Der per os einzunehmende Faktor-Xa-Hemmstoff Rivaroxaban (XARELTO) ist seit 2008 in einer Tagesdosis von 10 mg zur Thromboembolieprophylaxe nach Hüft- und Kniegelenksersatz zugelassen (a-t 2008; 39: 109-11). Wie schon der Thrombinhemmer Dabigatran (PRADAXA; a-t 2011; 42: 74-77) steht jetzt auch Rivaroxaban zur Prophylaxe von Schlaganfällen und systemischen Embolien bei Patienten mit nichtvalvulärem Vorhofflimmern zur Verfügung. Die Patienten müssen mindestens einen moderaten Risikofaktor wie Herzinsuffizienz, Alter von mindestens 75 Jahren, Diabetes oder Hypertonie aufweisen oder mindestens einen starken Risikofaktor wie Schlaganfall oder transitorische ischämische Attacke (TIA) in der Anamnese. Die Tagesdosis beträgt einmal 20 mg, bei Kreatininclearance von 30 bis 49 ml/min 15 mg. Gleichzeitig wird die Zulassung um die Therapie (2 x 15 mg/d) und die Rezidivprophylaxe (20 mg/d) tiefer Venenthrombosen erweitert.1
Schlaganfallprophylaxe bei nichtvalvulärem Vorhofflimmern
KLINISCHE STUDIE: Basis der Zulassung bildet die doppelblinde randomisierte, vom Hersteller finanzierte ROCKET-AF*-Studie.2 Aufgenommen werden 14.264 Patienten mit mindestens zweimalig dokumentiertem Vorhofflimmern und einem starken oder - abweichend von der Zulassung - mindestens zwei moderaten Risikofaktoren für Schlaganfälle. Relevante Mitralstenose, künstliche Herzklappe, anamnestisch oder aktuell erhöhtes Blutungsrisiko, frischer Schlaganfall, relevante Lebererkrankung und schwere Niereninsuffizienz (Kreatininclearance unter 30 ml/min) zählen zu den Ausschlussgründen.2
Die Patienten nehmen einmal täglich 20 mg Rivaroxaban oder Warfarin (COUMADIN) in adjustierter Dosis (INR 2-3) ein. Als Begleitbehandlung sind als Monotherapie Azetylsalizylsäure (ASS; ASPIRIN, Generika) bis 100 mg pro Tag und Thienopyridine wie Clopidogrel (PLAVIX, Generika) erlaubt. Daueranwendung nichtsteroidaler Antirheumatika (NSAR) ist Ausschlussgrund. Primäres Zielkriterium sind Schlaganfälle oder systemische Embolien. Sekundäre Endpunkte bilden die Kombinationen aus Schlaganfällen, systemischen Embolien, kardiovaskulären Todesfällen mit bzw. ohne Myokardinfarkte, die Einzelkomponenten der kombinierten Endpunkte und die Gesamtmortalität. Primäres Sicherheitskriterium sind schwere Blutungen, definiert als Hämoglobinabfall um mindestens 2 g/dl, Transfusionsbedarf von mindestens zwei Einheiten, tödliche oder kritische Organblutungen, plus nichtschwere, aber klinisch relevante Blutungen, definiert als Blutungen, die eine medizinische Intervention erfordern oder die Patienten beeinträchtigen.2
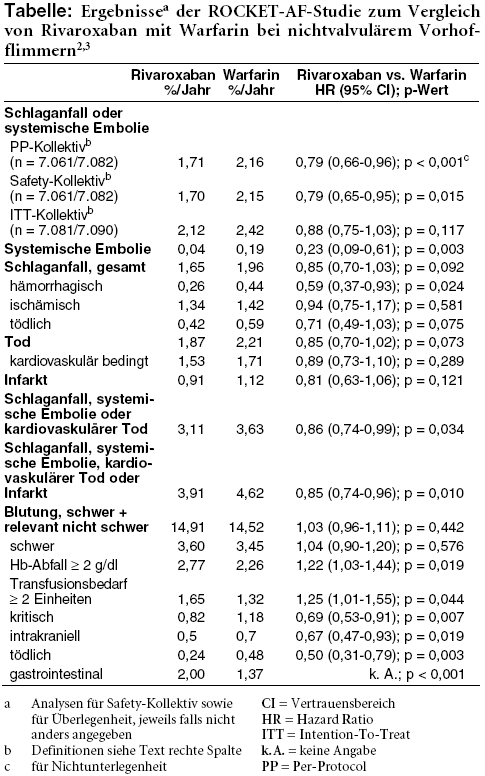
Für den primären Endpunkt wird zunächst auf Nichtunterlegenheit von Rivaroxaban gegenüber Warfarin im protokollgerecht behandelten und bis zwei Tage nach Beendigung der Medikation nachbeobachteten Patientenkollektiv getestet (Per-Protokoll [PP-]Kollektiv). Beim Nachweis von Nichtunterlegenheit wird auf Überlegenheit geprüft, und zwar in dem Kollektiv, das bis zu zwei Tage nach Absetzen der Medikation unabhängig von protokollgerechter Behandlung nachbeobachtet wurde (so genanntes Safety-Kollektiv). Unter Rivaroxaban brechen 23,7% der Patienten die Medikation vorzeitig ab, unter Warfarin 22,2%. Für die Nachbeobachtung relevanter Ereignisse fehlen jedoch nur die Daten von 32 Patienten. Zusätzliche Intention-To-Treat (ITT)-Analysen betrachten alle randomisierten Patienten bis zum Abschluss der Gesamtstudie nach medianer Dauer von knapp zwei Jahren.2
Die Patienten sind im Mittel 73 Jahre alt. 60% sind Männer. 81% leiden an persistierendem Vorhofflimmern. Der CHADS2**-Score liegt im Mittel bei 3,5. Bei 55% ist anamnestisch ein Schlaganfall, eine TIA oder eine systemische Embolie bekannt, bei 62% Herzinsuffizienz, bei 91% Hypertonie und bei 40% Diabetes. 37% sind mit ASS und 62% mit Cumarinen vorbehandelt.2,3
Primäre Endpunktereignisse treten im PP-Kollektiv unter Rivaroxaban jährlich bei 1,71% der Patienten auf, unter Warfarin bei 2,16%. Rivaroxaban erweist sich als nicht unterlegen (Tabelle). Im Safety-Kollektiv zeigt sich eine Überlegenheit von Rivaroxaban (1,70% versus 2,15%), nicht aber im ITT-Kollektiv über die gesamte Beobachtungszeit (2,12% vs. 2,42%), da nach Beendigung der Studienmedikation unter Rivaroxaban deutlich häufiger Schlaganfälle oder Embolien eintreten als unter Warfarin, vor allem an den Tagen 3 bis 30 (6,4% vs. 1,7% pro Jahr; p = 0,004). Als Ursache wird eine passagere Hyperkoagulabilität diskutiert, aber auch das Fehlen einer Handlungsanweisung für die Prüfärzte, wie beim Wechsel von Rivaroxaban auf andere Antikoagulanzien zu verfahren ist. Das Safety-Kollektiv profitiert zudem nur innerhalb der ersten 180 Tage von Rivaroxaban (primärer Endpunkt 1,66% vs. 2,66; p = 0,007) und nicht mehr in der Folgezeit (1,71% vs. 1,96%; p = 0,253). Letzteres trifft vor allem für mit Cumarinen vorbehandelte Patienten zu (1,71% vs. 1,73%; p = 0,948).2,3
Systemische Embolien sind unter Rivaroxaban noch seltener als unter Warfarin. Schlaganfälle insgesamt, Infarkte sowie kardiovaskuläre und Todesfälle insgesamt treten unter Rivaroxaban numerisch geringfügig seltener auf. Hämorrhagische Schlaganfälle und die beiden kombinierten Endpunkte sind geringfügig, aber signifikant seltener (Tabelle).2,3
UNERWÜNSCHTE WIRKUNGEN: Schwere sowie klinisch relevante nichtschwere Blutungen kommen unter Rivaroxaban nicht signifikant häufiger vor als unter Warfarin. Unter den schweren Blutungen sind Hämoglobinabfall um mindestens 2 g/dl und Transfusionsbedarf von mindestens zwei Einheiten signifikant häufiger, tödliche, intrakranielle und kritische Organblutungen dagegen signifikant seltener als unter Warfarin. Schwere Magen-Darm-Blutungen finden sich unter Rivaroxaban häufiger (Tabelle).2,3
Im Studienverlauf werden unter Rivaroxaban bei 81,4% und unter Warfarin bei 81,5% der Patienten unerwünschte Ereignisse erfasst. Unter diesen sind nur Nasenbluten (10,1% vs. 8,6%) und Hämaturie (4,2% vs. 3,4%) unter Rivaroxaban signifikant häufiger als unter Warfarin.
SUBGRUPPEN: Geschlecht, Gewicht, Art des Vorhofflimmerns, CHADS2-Score, Begleiterkrankungen wie Herzinsuffizienz oder Vorbehandlung mit ASS oder Cumarinen haben ebenso wie die verschiedenen Regionen, in denen die Studie durchgeführt wurde, keinen Einfluss auf das Ergebnis.
Obwohl Rivaroxaban nur zu einem Drittel renal eliminiert wird, erhöht bereits eine mäßige Niereninsuffizienz (Kreatininclearance 30-49 ml/min) die Plasmaspiegel um 50% und die Hemmung von Faktor-Xa um 90%.1 Bei diesen Patienten muss die Tagesdosis daher auf 15 mg reduziert werden. Patienten mit mäßiger Niereninsuffizienz haben in ROCKET-AF höhere Schlaganfall- und Blutungsraten als Patienten mit leicht eingeschränkter (Clearance 50-80 ml/min) oder normaler Nierenfunktion. Das Risiko nimmt allerdings unter Warfarin ähnlich zu wie unter Rivaroxaban (Interaktionstest p = 0,715).2,4
In den stratifizierten Subgruppen der Patienten mit bzw. ohne Schlaganfall, TIA oder systemische Embolie in der Anamnese (55% bzw. 45%) weichen die Ergebnisse auffällig und signifikant voneinander ab: Der primäre Endpunkt wird unter Rivaroxaban nur bei Patienten ohne solche Anamnese gemindert (HR 0,59 vs. HR 0,92; Interaktionstest p = 0,035).2
23% der Patienten nehmen für mehr als die Hälfte der Studiendauer begleitend ASS. Schwere Blutungen treten bei ihnen fast doppelt so häufig auf wie bei Patienten ohne ASS. Das Risiko nimmt allerdings unter Rivaroxaban und Warfarin in ähnlichem Maße zu. Kritische oder tödliche Blutungen sind bei diesen Patienten unter Rivaroxaban numerisch seltener als unter Warfarin. Ein ähnliches Bild zeigt sich bei den wenigen (1,8%) Patienten, die zusätzlich ASS plus ein Thienopyridin einnehmen. Begleitmedikation mit NSAR hat ebenfalls keinen Einfluss auf die Ergebnisse für Rivaroxaban.3
INR-EINSTELLUNG: Die INR-Werte unter Warfarin liegen in ROCKET-AF im Mittel nur in 55% (Westeuropa 61%) der Zeit im therapeutischen Bereich (TTR***), in 29% (22%) darunter und in knapp 16% (17%) darüber.3 Die INR-Einstellung ist hier somit noch schlechter als in der RE-LY****-Studie mit Dabigatran bei nichtvalvulärem Vorhofflimmern (TTR im Mittel 64%).5 TTR-Werte korrelieren streng mit dem Auftreten von Blutungen und Schlaganfällen unter Cumarinen.6 Die Zentren-bezogenen Analysen durch den Sponsor von ROCKET-AF finden zwar keinen Zusammenhang der Ergebnisse für Rivaroxaban mit der Güte der INR-Einstellung.2 Die TTR-Analysen entsprechen laut FDA jedoch nicht dem Standard und überschätzen die Werte. Die Analysen sind auch schon deshalb wenig aussagekräftig, da nur ein Viertel der TTR-Werte über 65,7% liegt. Zum Vergleich: In Spezialambulanzen oder bei Selbstmanagement werden meist mittlere TTR-Werte über 70% erreicht.6 Weitere Auswertungen der ROCKET-AF-Daten durch die FDA zeigen, dass die Hazard Ratio für den primären Endpunkt unter Rivaroxaban ab einem TTR-Wert von 65% steil ansteigt und ab 67% über 1 liegt, d.h. Schlaganfälle und Embolien unter Rivaroxaban dann häufiger sein könnten als unter Warfarin.3
KONTROVERSE UM ZULASSUNG: Der Bewertungsbericht der europäischen Zulassungsbehörde ist bisher nicht publiziert. Der Zulassung von Rivaroxaban für Vorhofflimmern durch die FDA im November 2011 gingen kontroverse Diskussionen voraus. Die FDA-eigenen Reviewer sprechen sich in erster Linie wegen der nicht fachgerechten Anwendung von Warfarin in der ROCKET-AF-Studie gegen die Zulassung aus.8 Sie betonen eingehend die gut dokumentierte Abhängigkeit der Warfarin-Effektivität von der INR-Einstellung9,10 und den deutlichen Wirkverlust schon bei Werten wenig unter 2.11,12 Zudem monieren sie das Fehlen adäquater Dosisfindungsstudien für Rivaroxaban und die tägliche Einmaldosis in ROCKET-AF, die wegen der Halbwertszeit von fünf bis neun Stunden pharmakologisch nicht plausibel und auch nach kinetischen Daten nicht optimal ist, sowie nicht zuletzt das Fehlen ausreichend erprobter Strategien zur Verminderung des erhöhten Schlaganfallrisikos beim Beenden oder Umstellen der Therapie.3
Mehrere Mitglieder des externen Beraterkomitees der FDA äußern ebenfalls ernsthafte Bedenken, das Komitee spricht sich aber schließlich mit neun zu zwei Stimmen bei einer Enthaltung für die Zulassung aus.13 Es hält die Nichtunterlegenheit von Rivaroxaban für ausreichend belegt, sieht die besonderen Schwierigkeiten bei der Betreuung von Hochrisikopatienten und das doppelblinde Design als ursächlich für die schlechte INR-Einstellung unter Warfarin in ROCKET-AF an und hält die Dosierungs- und Umstellungsfragen in Postmarketingstudien für klärbar.14 Das Komitee folgt damit einem Meinungsbildner aus seinen Reihen, der einer der Hauptprüfer der Studie ist.15
Therapie und Rezidivprophylaxe tiefer Venenthrombosen
KLINISCHE STUDIEN: Grundlage dieser Zulassung für Rivaroxaban sind zwei gemeinsam publizierte, randomisierte Studien, die EINSTEIN-DVT*****-Studie zur Akuttherapie tiefer Venenthrombosen und die EINSTEIN-Extensionsstudie zur verlängerten Prophylaxe nach tiefer Venenthrombose und Lungenembolie.16 Eine weitere abgeschlossene, noch nicht publizierte EINSTEIN-Studie prüft Rivaroxaban zur Akuttherapie bei tiefer Venenthrombose und Lungenembolie.17
An der offen durchgeführten DVT-Studie zur Akuttherapie nehmen 3.449 Patienten mit symptomatischer proximaler tiefer Venenthrombose ohne Lungenembolie teil. Sie nehmen entweder drei Wochen lang zweimal täglich 15 mg und anschließend einmal täglich 20 mg Rivaroxaban ein oder erhalten mindestens fünf Tage lang zweimal täglich 1 mg/kg Enoxaparin (CLEXANE) subkutan, überlappend gefolgt von Warfarin oder Acenocoumarol (außer Handel: SINTROM) per os mit INR-Zielwerten von 2 bis 3. Die Behandlungsdauer kann drei, sechs oder zwölf Monate betragen und wird durch den Prüfarzt festgesetzt. Geprüft wird primär auf Nichtunterlegenheit im ITT-Kollektiv.16
An der doppelblinden Extensionsstudie nehmen 1.197 Patienten teil, die wegen symptomatischer tiefer Venenthrombose oder Lungenembolie bereits sechs bis zwölf Monate lang Warfarin, Acenocoumarol oder Rivaroxaban eingenommen haben. 53% rekrutieren sich aus den EINSTEIN-Akutstudien. Sie nehmen einmal täglich 20 mg Rivaroxaban oder Plazebo ein. Die Behandlungsdauer wird wiederum durch den Prüfarzt festgelegt und kann sechs oder zwölf Monate betragen. Geprüft wird primär auf Überlegenheit im ITT-Kollektiv.16
Zu den Ausschlussgründen gehören in beiden Studien schwere Niereninsuffizienz (Kreatininclearance unter 30 ml/ min), relevante Lebererkrankungen, aktive Blutungen oder hohes Blutungsrisiko und Begleittherapien mit starken CYP-3A4-Hemmern oder -Induktoren. ASS sowie Clopidogrel sind als Begleitmedikation in Tagesdosen bis 100 mg bzw. 75 mg erlaubt. NSAR sollen gemieden werden.16
Primärer Endpunkt sind in beiden Studien symptomatische, objektivierte Rezidive venöser Thromboembolien, definiert als tiefe Venenthrombose oder Lungenembolie. Als sekundäre Endpunkte werden Todesfälle und vaskuläre Ereignisse wie akutes Koronarsyndrom, Schlaganfall oder systemische Embolie prädefiniert. Primärer Sicherheitsendpunkt sind in der DVT-Studie schwere plus nichtschwere, aber klinisch relevante Blutungen, in der Extensionsstudie nur schwere Blutungen. Die Definitionen entsprechen denen der ROCKET-AF-Studie. Die Kombination aus primärem Endpunkt und schweren Blutungen dient zur Abschätzung des klinischen Nutzens.16
Die Patienten der DVT- bzw. Extensionsstudie sind im Mittel 56 bzw. 58 Jahre alt, je 7% weisen eine mäßige Niereninsuffizienz auf. Bei 62% bzw. 74% sind keine Auslöser für die Thromboembolien feststellbar. In der DVT-Studie werden 12% der Patienten drei, 63% sechs und 25% zwölf Monate lang behandelt. Die Patienten der Extensionsstudie sind im Mittel 205 Tage vorbehandelt, 72% mit einem Cumarin. Bei 38% ist eine Lungenembolie der Behandlungsgrund. Bei 60% wird eine Behandlungsdauer von sechs, sonst von zwölf Monaten festgelegt. Rivaroxaban wird in den Studien seltener als das Cumarin (11,3% vs. 14,2%) bzw. Plazebo abgebrochen (12,6% vs. 15,7%). 1% bzw. 0,2% der Patienten sind hinsichtlich des primären Endpunkts nicht nachverfolgbar. In der DVT-Studie liegt der INR-Wert unter den Cumarinen in 58% der Zeit im therapeutischen Bereich, in 16% darüber und in 25% der Zeit darunter.16
Die DVT-Studie zeigt Nichtunterlegenheit von Rivaroxaban gegenüber den Cumarinen: Zu einem Thromboembolierezidiv kommt es bei 2,1% gegenüber 3,0% (HR 0,68 mit CI 0,44-1,04; p < 0,001 für Nichtunterlegenheit). Die Ergebnisse fallen in der Per-Protokoll-Analyse gleich aus. Unter Rivaroxaban treten tendenziell weniger Todesfälle auf (2,2% vs. 2,9%; p = 0,06), vaskuläre Ereignisse sind gleich häufig (0,7% vs. 0,8%). Auch die Raten an schweren plus nichtschweren, aber klinisch relevanten Blutungen (je 8,1%) und schweren Blutungen allein (0,8% vs. 1,2%) unterscheiden sich nicht. Der klinische Benefit fällt zu Gunsten von Rivaroxaban aus (2,9% vs. 4,2%; p = 0,03). Schwerwiegende (12,0% vs. 13,6%) sowie unerwünschte Ereignisse, die zum Studienabbruch (4,9% vs. 4,7%) führen, sind gleich häufig. Gelegentlich steigen die Leberwerte (0,1% vs. 0,2%). Subgruppeneffekte sind weder für Alter, Geschlecht, Gewicht, Nierenfunktion oder Cumarintyp noch für die Studienregion nachweisbar.
In der Extensionsstudie treten primäre Endpunktereignisse unter Rivaroxaban signifikant seltener auf als unter Plazebo: 1,3% vs. 7,1% (HR 0,18; 95% CI 0,09-0,39; p < 0,001). Dies trifft für tiefe Thrombosen (0,3% vs. 2,2%) wie für nichttödliche Lungenembolien (0,8% vs. 5,2%) zu. Für tödliche Lungenembolien (0% vs. 0,2%), Todesfälle insgesamt (0,2% vs. 0,3%) und vaskuläre Ereignisse (0,5% vs. 0,8%) ergeben sich keine signifikanten Unterschiede. Schwere plus nichtschwere, aber klinisch relevante Blutungen (6,0% vs. 1,2%; p < 0,001), nicht aber schwere Blutungen allein (0,7% vs. 0%; p = 0,11) sind unter Rivaroxaban häufiger als unter Plazebo. Relevante Anstiege der Leberwerte finden sich in der Studie nicht. Der klinische Benefit fällt wiederum zu Gunsten von Rivaroxaban aus (2,0% vs. 7,1%; p < 0,001). Subgruppeneffekte finden sich nicht.
STUDIENKRITIK: Die Aussagekraft der Ergebnisse ist auch bei der DVT-Studie durch die schlechte Einstellung der INR-Werte im Cumarinarm eingeschränkt. Der Einfluss der INR-Einstellung auf die Effektivität der Cumarintherapie kann wegen fehlender Analysen jedoch nicht abgeschätzt werden. Die Ergebnissicherheit wird zudem durch die fehlende Verblindung geschmälert: Da die Diagnostik zur Objektivierung der Endpunktereignisse durch subjektive Beschwerden der Patienten getriggert wird, sind systematische Verzerrungen zu Gunsten von Rivaroxaban möglich. Die Autoren halten die Gefahr für gering, da die Rate der zunächst vermuteten Ereignisse unter Rivaroxaban höher ist.16
Die Ergebnisse der Extensionsstudie sind nicht unerwartet: Eine Reduktion der Thromboembolierezidive durch Verlängerung der Sekundärprophylaxe ist in mehreren randomisierten Studien belegt, vor allem nach so genannten idiopathischen Thromboembolien ohne erkennbaren Auslöser.18,19 Die Autoren verteidigen den Vergleich gegen Plazebo damit, dass bei den Patienten substanzielle fachliche Unsicherheit ("Equipoise") über die Notwendigkeit einer weitergeführten Antikoagulation bestehen musste.16 Auch unter diesem Aspekt wäre aber eine dreiarmige Studie gegenüber Plazebo und einem Cumarin sinnvoll gewesen.
Offene Fragen für die Praxis
LABORKONTROLLEN: Rivaroxaban beeinflusst die aktivierte partielle Thromboplastinzeit, die Faktor-Xa-Aktivität und die INR-Werte. Falls klinisch notwendig, wird zur Messung der Prothrombinzeit geraten. Sie korreliert am engsten mit dem Plasmaspiegel von Rivaroxaban und liegt unter Tagesdosierungen von 20 mg zum Zeitpunkt des Wirkmaximums bei Patienten mit Vorhofflimmern zwischen 14 und 40 Sekunden, bei der Thromboembolieprophylaxe zwischen 15 und 30 Sekunden. Für die Routine werden unter einer Therapie mit Rivaroxaban aber keine Laborkontrollen empfohlen.1
ANTIDOT: Ein spezifisches Antidot für Rivaroxaban ist nicht bekannt. In einer kleinen randomisierten Cross-Over-Studie an zwölf Gesunden kann eine Einzeldosis von 50 IE/kg Prothrombinkonzentrat (PPSB) die Prothrombinzeit, die unter zweimal täglich 20 mg Rivaroxaban um drei Sekunden verlängert ist, prompt und komplett normalisieren. Bei Behandlung mit zweimal täglich 150 mg Dabigatran bleibt PPSB ohne jeden Effekt auf Thrombinzeit und andere Gerinnungstests, mit denen die Wirkung von Dabigatran erfasst wird.20 Ob PPSB bei akuten Blutungskomplikationen unter Rivaroxaban effektiv ist, bleibt aber offen und durch klinische Studien zu klären. In ROCKET-AF korreliert die Prothrombinzeit mit der Rate von Blutungen insgesamt, nicht aber mit der tödlicher oder kritischer Organblutungen.3 Ein begleitendes Editorial warnt vor kritiklosem Einsatz, zumal thrombogene Effekte von PPSB gut bekannt sind.21
ABSETZEN BZW. UMSTELLEN: Rivaroxaban soll laut Fachinformation mindestens 24 Stunden vor invasiven Verfahren und operativen Eingriffen abgesetzt werden. Angaben zu Bridging-Verfahren fehlen.1 Angesichts der Erfahrungen in ROCKET-AF, die bei Beendigung oder Umstellung von Rivaroxaban ein deutlich erhöhtes Risiko für embolische Ereignisse erkennen lässt, erscheinen die Empfehlungen riskant und unzureichend. Ebenso fehlen dokumentierte Erfahrungen für den Hinweis, dass bei Umstellung von Cumarinen mit Rivaroxaban bereits ab INR-Werten unter 3 bzw. 2,5 begonnen werden soll.1 Beim Umstellen auf Cumarine muss Rivaroxaban noch eingenommen werden, bis die INR-Werte über 2 liegen. Da Rivaroxaban selbst und bei gleichzeitiger Einnahme von Cumarinen mehr als additiv die INR-Werte erhöht, sollten Messungen möglichst erst 24 Stunden nach der letzten Einnahme erfolgen.
INTERAKTIONEN: Gleichzeitige Anwendung starker Induktoren von CYP 3A4 wie Rifampicin (RIFA, Generika), Carbamazepin (TEGRETAL, Generika) oder Johanniskraut (JARSIN u.a.) kann zum Wirkverlust führen. Komedikation mit CYP-3A4-Hemmstoffen ist problematisch und kontraindiziert, wenn diese wie Azolantimykotika (z.B. Itraconazol [SEMPERA, Generika]) oder Proteasehemmer (z.B. Ritonavir [NORVIR]) auch das p-Glykoprotein stark hemmen. Ein weiterer Anstieg des Blutungsrisikos unter Rivaroxaban ist bei Komedikation mit NSAR anzunehmen. ASS verdoppelt das Risiko selbst in Tagesdosen bis 100 mg. Gleiches dürfte für Thienopyridine wie Clopidogrel in üblicher Dosis gelten. Auch wenn Rivaroxaban anders als Dabigatran, unter dem akute koronare Ereignisse nach einer aktuellen Metaanalyse um 30% zunehmen,22 das Herzinfarktrisiko nicht erhöht, spricht das Vorliegen einer koronaren Herzkrankheit gegen Rivaroxaban und für Cumarine, da unter Cumarinen in der Regel auf ASS verzichtet und ein Anstieg des Blutungsrisikos durch die Komedikation vermieden werden kann.23
Behandlungskosten
Die Tagestherapiekosten für Rivaroxaban bei Vorhofflimmern oder venösen Thromboembolien liegen 15- bis 20-fach über den reinen Medikamentenkosten für Phenprocoumon (MARCUMAR, Generika). Die Jahreskosten liegen damit - ähnlich wie bei Dabigatran - gut tausend Euro über denen für ein Cumarin einschließlich der zusätzlichen Kosten für zweiwöchentliche INR-Messungen. Dabei könnten nach einer aktuellen randomisierten Studie bei stabil eingestellten Patienten zwölfwöchige Kontrollintervalle so sicher und effektiv sein wie vierwöchige.24

Der per os einzunehmende Faktor-Xa-Hemmer Rivaroxaban (XARELTO) ist jetzt auch für Patienten mit nichtvalvulärem Vorhofflimmern, die einer Antikoagulation bedürfen, sowie zur Therapie tiefer Venenthrombosen und Rezidivprophylaxe venöser Thromboembolien zugelassen.
Tagesdosierungen von einmal 20 mg verhindern bei Vorhofflimmern Schlaganfälle und systemische Embolien nicht schlechter als Warfarin (COUMADIN). Eine Überlegenheit gegenüber Warfarin ist aber nicht hinreichend nachgewiesen.
Während der Therapie sind systemische Embolien und hämorrhagische Schlaganfälle unter Rivaroxaban um 0,15% bzw. 0,18% pro Jahr seltener, und die Mortalität sinkt tendenziell um 0,38% 0,34%. (Korrektur nach Drucklegung)
Nach Beendigung bzw. Umstellen der Therapie ist ein Rebound jedoch nicht auszuschließen.
Schwere sowie schwere plus klinisch relevante Blutungen sind unter Rivaroxaban numerisch geringfügig häufiger als unter Warfarin. Tödliche und kritische Organblutungen treten signifikant um 0,24% bzw. 0,36% seltener, Magen-Darm-Blutungen um 0,63% häufiger auf.
Vor allem wegen der schlechten Einstellung der INR-Werte in der Vergleichsgruppe, die im Mittel nur in 55% der Zeit im therapeutischen Bereich liegen, ist die Aussagekraft der Zulassungsstudie stark eingeschränkt.
Bei der Therapie tiefer Venenthrombosen über drei bis zwölf Monate erweist sich Rivaroxaban dem Standard aus Enoxaparin (CLEXANE), gefolgt von einem Cumarin als nicht unterlegen. Weder Rezidive noch Blutungen sind aber signifikant seltener.
Nach sechs- bis zwölfmonatiger Rezidivprophylaxe wegen tiefer Venenthrombosen oder Lungenembolien vermindert Rivaroxaban über weitere sechs bis zwölf Monate im Plazebovergleich Thromboembolien um 5,8%. Blutungen nehmen um 4,8% zu, schwere Blutungen und Todesfälle sind gleich häufig.
Ähnliche Befunde sind auch für Cumarine bekannt. Direktvergleiche hiermit fehlen.
Für die Praxis ist vor allem die Vorgehensweise bei anstehenden Operationen und beim Umstellen von Cumarinen sowie auf Cumarine unzureichend geklärt.
Rivaroxaban beeinflusst auch die üblichen Gerinnungstests. Kontrollen werden aber für die Routine nicht empfohlen. Ob sich im Notfall Prothrombinkonzentrat (PPSB) als Antidot eignet, bedarf weiterer Klärung.
Die Zusatzkosten für Rivaroxaban von 1.000 € pro Jahr wären nach derzeitigem Kenntnisstand lediglich für einen verbesserten Patienten- und Behandlungskomfort aufzubringen, der zudem weder bewiesen noch quantifiziert ist.
In der Therapie und Rezidivprophylaxe von Thromboembolien sehen wir Rivaroxaban nur bei Kontraindikationen für Cumarine als Option. Bei Vorhofflimmern ist es unseres Erachtens dritte Wahl nach Cumarinen und Dabigatran (PRADAXA).
| (R =randomisierte Studie, M = Metaanalyse) | |
| 1 | Bayer: Fachinformation XARELTO 15 mg und 20 mg, Dezember 2011 |
| R 2 | PATEL, M.R. et al.: N. Engl. J. Med. 2011; 365: 883-91 |
| 3 | FDA: Briefing Document, Advisory Committee Meeting, 8. Sept. 2011 http://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/ Drugs/CardiovascularandRenalDrugsAdvisoryCommittee/UCM270796.pdf |
| 4 | FOX, K.A. et al.: Eur. Heart J. 2011; 32: 2387-94 |
| R 5 | CONNOLLY, S.J. et al.: N. Engl. J. Med. 2009; 361: 1139-51 |
| 6 | ANSELL, J. et al.: Chest 2008; 133: S160-98 |
| 7 | ROSENDAAL, F.R. et al.: Thromb. Haemost. 1993; 69: 236-39 |
| 8 | O`RIORDAN, M.: Heartwire vom 7. Sept. 2011; http://www.theheart.org/article/1274085/print.do (kostenloser Login erforderlich) |
| R 9 | CONNOLLY, S.J. et al.: Circulation 2008; 118: 2029-37 |
| R 10 | WHITE, H.D. et al.: Arch Intern Med. 2007; 167: 239-45 |
| 11 | HYLEK, E.M. et al.: N. Engl. J. Med. 1996; 335: 540-6 |
| 12 | HYLEK, E.M. et al.: N. Engl. J. Med. 2003; 349: 1019-26 |
| 13 | O`RIORDAN, M.: Heartwire vom 4. Nov. 2011; http://www.theheart.org/article/1304213/print.do (kostenloser Login erforderlich) |
| 14 | FLEMING, T.R., SCOTT, P.D.: N. Engl. J. Med. 2011; 365: 1557-59 |
| 15 | MITKA, M.: JAMA 2011; 306: 1851-52 |
| R 16 | The EINSTEIN Investigators: N. Eng. J. Med. 2010; 363: 2499-510 |
| 17 | http://www.clinicaltrials.gov/ct2/show/NCT00439777 |
| 18 | KEARON, C. et al.: Chest 2008; 133: S454-545 |
| 19 | SEGAL, J.B. et al.: Ann. Intern. Med. 2007; 146: 211-22 |
| R 20 | EERENBERG, E.S. et al.: Circulation 2011; 124: 1573-79 |
| 21 | BATTINELLI, E.M.: Ciculation 2011; 124: 1508-10 |
| M 22 | UCHINO, K. et al.: Arch. Intern. Med. 2012; online publ. am 9. Jan. 2012 |
| M 23 | HURLEN, M., ARNESEN, H.: Herz 2008; 33: 38-43 |
| R 24 | SCHULMAN, S. et al.: Ann. Intern. Med. 2011; 155: 653-59 |
| * | ROCKET-AF = Rivaroxaban Once Daily Oral Direct Factor Xa Inhibition Compared with Vitamin K Antagonism for Prevention of Stroke and Embolism Trial in Atrial Fibrillation |
| ** | CHADS2 = Congestive heart failure, Hypertension, Age of 75 years or older, Diabetes mellitus, previous Stroke or transient ischemic attack: Score, mit dem das Schlaganfallrisiko bei Vorhofflimmern geschätzt wird. Für je einen der ersten vier Risikofaktoren wird 1 Punkt vergeben, bei vorausgegangenem ischämischen zerebrovaskulären Ereignis 2 Punkte (vgl. a-t 2011; 42: 20) |
| *** | TTR = Time in Therapeutic Range; Zeit mit INR-Werten zwischen 2 und 3 |
| **** | RE-LY = Randomized Evaluation of Long-term Anticoagulation TherapY |
| ***** | EINSTEIN = keine Erklärung für das Akronym gefunden DVT = Deep Vein Thrombosis |
© 2012 arznei-telegramm, publiziert am 13. Januar 2012
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
