Seit April 2001 wird Sirolimus (RAPAMUNE) zur Immunsuppression nach Nierentransplantation angeboten. Das Makrolid wurde erst im zweiten Anlauf
und für eine sehr eingeschränkte Indikation EU-weit zugelassen. Anders als in den USA darf es hier nicht langfristig mit Ciclosporin A (SANDIMMUN u.a.)
kombiniert werden. Patienten mit hohem Risiko einer Transplantatabstoßung dürfen das Mittel nicht einnehmen. Sirolimus soll weniger blutdrucksteigernd
und nierenschädigend wirken als das Standardimmunsuppressivum Ciclosporin - so der Hersteller Wyeth. Die klinischen Daten geben ein anderes Bild.
Die Zulassung von Sirolimus in den USA - als "add on" zu Ciclosporin (plus Glukokortikoide*) - basiert auf zwei doppelblinden Studien mit insgesamt 1.300
Patienten. Die Kombination beeinflusst das primäre Zielkriterium - akute Abstoßungsreaktionen, Verlust des Transplantats oder Tod - nach sechs
Monaten besser als Ciclosporin plus Azathioprin (IMUREK u.a.) oder Ciclosporin allein.* Dieser Vorteil beruht anscheinend ausschließlich auf Verminderung
akuter Abstoßungsreaktionen. Die Bedeutung dieses Parameters für die Langzeitprognose ist aber nicht hinreichend geklärt. Sterblichkeit und
Transplantatverlust nach einem Jahr unterscheiden sich nicht.1-3 Die Transplantatfunktion hat sich unter Sirolimus plus Ciclosporin sogar deutlich
verschlechtert.2,4
Die Europäische Arzneimittelbehörde (EMEA) lehnt die Zulassung auf der Basis dieser Daten ab. Die Firma widerspricht und präsentiert Ergebnisse
von zwei nicht publizierten Untersuchungen zur Monotherapie* mit Sirolimus, im Anschluss an ein Kombinationsschema in der Akutphase nach
Transplantation. Diese Erhaltungstherapie mit Sirolimus allein wird nicht, wie zu erwarten, mit einem Standardregime verglichen, zum Beispiel Ciclosporin plus
Azathioprin.* Die Kontrollgruppen erhalten vielmehr langfristig die Kombination aus Ciclosporin und Sirolimus, die die EMEA wegen Sicherheitsbedenken abgelehnt
hat. Akute Abstoßungsreaktionen kommen unter Sirolimus-Monotherapie häufiger vor. Häufigkeit der Transplantatverluste und Sterblichkeit
unterscheiden sich nicht. Die Transplantatfunktion ist unter der Kombination wiederum schlechter.4 Eine (Neu-)Bewertung des Nutzen-
Schaden-Verhältnisses von Sirolimus lassen die Daten wegen der inadäquaten Kontrolltherapie nicht zu. Die Phase-II-Studien sind mit höchstens 42
Patienten pro Studienarm für definitive Aussagen zu klein. Dass die Zulassungsentscheidung auf dieser Datenbasis - in den USA wie in der EU - positiv
ausfallen konnte, ist nicht nachvollziehbar (s. Seite 58).
Unerwünschte Wirkungen der Monotherapie mit Sirolimus sind unzureichend dokumentiert. Deutlich erhöhte Serumcholesterin- und
Triglyzeridspiegel machen bei zwei von drei Studienteilnehmern Lipidsenker erforderlich.4 Unter der Kombination mit Ciclosporin sind typische Schadeffekte
der Immunsuppression beschrieben wie Infektionen der oberen Atemwege und des Harntraktes, Anämie, Leukopenie u.a. (über 10%) sowie
lymphoproliferative Erkrankungen (0,1% bis 1%). Auffällig häufig kommen Akne (bis 31%), Tachykardie (bei mehr als 20%), Hypokaliämie (bis 17%)
und Thrombozytopenie (bis 14%) vor.1 Ob Sirolimus weniger blutdrucksteigernd wirkt als Ciclosporin, lässt sich mangels Vergleichsdaten nicht
beurteilen. Ob es, wie andere Makrolide, das QT-Intervall im EKG verlängert, ist nicht bekannt. Die europäische Fachinformation4 spiegelt die
Schadwirkungen von Sirolimus nur unzureichend wider. Kardiovaskuläre Effekte wie Vorhofflimmern, Herzversagen oder Thrombose1 werden nicht
erwähnt. Da Sirolimus über Zytochrom P450 3A4 verstoffwechselt wird, sind vielfältige Interaktionen zu beachten.
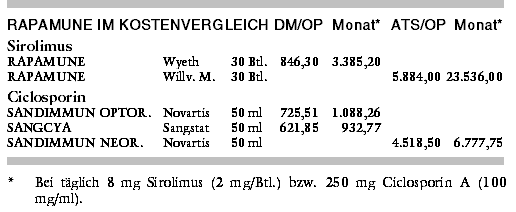
KOSTEN: Mit 3.385 DM bzw. 23.500 ATS kostet die Erhaltungstherapie mit täglich 8 mg Sirolimus (RAPAMUNE) pro Monat mindestens dreimal so viel
wie mit Ciclosporin A Mikroemulsion (SANDIMMUN OPTORAL: 1.088 DM, SANDIMMUN NEORAL: 6.800 ATS bei einem Körpergewicht von 65 kg und einer
Dosis von 250 mg/Tag). Mit dem Nachfolgepräparat SANGCYA (933 DM) lassen sich in Deutschland gegenüber SANDIMMUN 14% einsparen.
 Die in den USA zugelassene Kombination* des Immunsuppressivums
Sirolimus (RAPAMUNE) mit Ciclosporin A (SANDIMMUN u.a.) zur Dauerbehandlung nach Nierentransplantation scheint nephrotoxischer zu sein als die Ciclosporin-
Standardtherapie. Die EU hat das Schema daher abgelehnt. Die in den USA zugelassene Kombination* des Immunsuppressivums
Sirolimus (RAPAMUNE) mit Ciclosporin A (SANDIMMUN u.a.) zur Dauerbehandlung nach Nierentransplantation scheint nephrotoxischer zu sein als die Ciclosporin-
Standardtherapie. Die EU hat das Schema daher abgelehnt.
 Das Nutzen-Schaden-Verhältnis der in der EU zugelassenen Monotherapie* mit
Sirolimus im Anschluss an eine kurzfristige Kombination mit Ciclosporin A Mikroemulsion lässt sich nicht beurteilen. In den zulassungsrelevanten Studien wird
dieses Regime nur mit dem stärker nierenschädigenden US-amerikanischen Schema, nicht aber mit einer Standardtherapie verglichen. Das Nutzen-Schaden-Verhältnis der in der EU zugelassenen Monotherapie* mit
Sirolimus im Anschluss an eine kurzfristige Kombination mit Ciclosporin A Mikroemulsion lässt sich nicht beurteilen. In den zulassungsrelevanten Studien wird
dieses Regime nur mit dem stärker nierenschädigenden US-amerikanischen Schema, nicht aber mit einer Standardtherapie verglichen.
 Ausgeprägte Blutfettanstiege machen bei der Mehrzahl der Patienten eine
lipidsenkende Therapie erforderlich. Zusätzliche Kosten und Störeffekte sind absehbar. Ausgeprägte Blutfettanstiege machen bei der Mehrzahl der Patienten eine
lipidsenkende Therapie erforderlich. Zusätzliche Kosten und Störeffekte sind absehbar.
 Die Zulassung von Sirolimus ist auf der bisherigen Datenbasis nicht nachvollziehbar.
Wir sehen keine Indikation für das teure Mittel. Die Zulassung von Sirolimus ist auf der bisherigen Datenbasis nicht nachvollziehbar.
Wir sehen keine Indikation für das teure Mittel.

* |
Alle beschriebenen Schemata enthalten auch Glukokortikoide |
|


