Seit Juni ist das Neuroleptikum  Sertindol (SERDOLECT) wieder im Handel.
Wegen Kardiotoxizität war es 1998 nur 16 Monate nach Markteinführung vom Hersteller aus dem Verkehr gezogen worden (a-t 1999; Nr. 1: 19). Sertindol verlängert das QT-Intervall im EKG stärker als andere
Neuroleptika und kann so das Risiko für lebensbedrohliche Herzrhythmusstörungen, so genannte Torsade de pointes, erhöhen. In
Zulassungsstudien mit mehr als 1.400 Patienten und einer Einnahmedauer, die insgesamt nur etwa 476 Personenjahren entspricht, sind 12 plötzliche
Todesfälle sowie 23 Synkopen beobachtet worden.1 In den USA wurde das Mittel gar nicht erst zugelassen. Eine erhöhte Rate von
Verdachtsmeldungen über plötzliche Todesfälle und Herzrhythmusstörungen unter Sertindol im Vergleich mit anderen neueren Neuroleptika im
britischen Spontanerfassungssystem gab schließlich den Ausschlag für die weltweite Marktrücknahme und das Ruhen der Zulassung innerhalb der
EU.2-4 Die europäische Arzneimittelbehörde (EMEA) wertete die Nutzen-Schaden-Bilanz damals negativ, da ein Wirksamkeitsvorteil
gegenüber anderen Neuroleptika nicht belegt sei.4 Sertindol (SERDOLECT) wieder im Handel.
Wegen Kardiotoxizität war es 1998 nur 16 Monate nach Markteinführung vom Hersteller aus dem Verkehr gezogen worden (a-t 1999; Nr. 1: 19). Sertindol verlängert das QT-Intervall im EKG stärker als andere
Neuroleptika und kann so das Risiko für lebensbedrohliche Herzrhythmusstörungen, so genannte Torsade de pointes, erhöhen. In
Zulassungsstudien mit mehr als 1.400 Patienten und einer Einnahmedauer, die insgesamt nur etwa 476 Personenjahren entspricht, sind 12 plötzliche
Todesfälle sowie 23 Synkopen beobachtet worden.1 In den USA wurde das Mittel gar nicht erst zugelassen. Eine erhöhte Rate von
Verdachtsmeldungen über plötzliche Todesfälle und Herzrhythmusstörungen unter Sertindol im Vergleich mit anderen neueren Neuroleptika im
britischen Spontanerfassungssystem gab schließlich den Ausschlag für die weltweite Marktrücknahme und das Ruhen der Zulassung innerhalb der
EU.2-4 Die europäische Arzneimittelbehörde (EMEA) wertete die Nutzen-Schaden-Bilanz damals negativ, da ein Wirksamkeitsvorteil
gegenüber anderen Neuroleptika nicht belegt sei.4
Bereits 2002 hat die EMEA jedoch die Wiedereinführung von Sertindol erlaubt, allerdings zunächst mit der Einschränkung, dass nur Patienten das
Mittel einnehmen dürften, die an zwei Postmarketing-Sicherheitsstudien teilnehmen. Die Auswertung weiterer präklinischer und epidemiologischer Daten
einschließlich der vom Hersteller eingereichten Unterlagen habe, so die Behörde, die Sicherheitsbedenken nicht bestätigt, aber auch nicht
ausräumen können.4 Die von der Behörde geforderten Sicherheitsstudien sollen im Juli 2002 initiiert worden sein.5 Sie sind nach
Auskunft des Herstellers Lundbeck aber bisher weder abgeschlossen noch veröffentlicht.6,7
Anfang 2005 hat die EMEA alle Vermarktungsbeschränkungen für Sertindol aufgehoben8 - ohne veröffentlichte klinische Daten, anhand derer sich
diese Entscheidung nachvollziehen ließe. Auch mehr als ein Jahr später finden wir auf den Informationsseiten der Behörde keine wissenschaftliche
Begründung. In der Fachinformation heißt es lediglich, dass "klinische und nicht klinische Daten ... nicht belegen [konnten], dass Sertindol ein
größeres arrhythmogenes Potenzial als andere Antipsychotika hat".9 Solange nichts über die Studien bekannt ist, in denen Sertindol hier
geprüft wurde (ihre Validität, die Vergleichsneuroleptika, die Ergebnisse), lässt sich mit diesem Satz nichts anfangen. Wahrscheinlich verursachen alle
verfügbaren Neuroleptika elektrophysiologische Veränderungen, die das Risiko des plötzlichen Todes erhöhen können. Über das
genaue Ausmaß des Risikos in Verbindung mit den verschiedenen Neuroleptika ist jedoch nach wie vor wenig bekannt.10,11 Auch vor diesem
Hintergrund ist die Intransparenz der EMEA völlig unverständlich.
Neben der Verlängerung des QT-Intervalls werden heute auch andere elektrophysiologische Marker diskutiert und experimentell untersucht, die das
arrhythmogene Potenzial eines Arzneimittels vorhersagen sollen, möglicherweise sogar besser. Ein neuer Standard hat sich aber bisher nicht
herausgebildet.12,13 Die in der Fachinformation angeführten für Sertindol entlastenden Befunde aus solchen In-vitro-Versuchen sind in ihrer
klinischen Bedeutung unklar. Sie stellen anscheinend auch eine einseitige Auswahl dar: Während frühe Nachdepolarisationen, die als wesentliche
Auslöser für Torsade de pointes gelten, laut Fachinformation in Purkinje-Fasern von Kaninchen und Hunden nicht beobachtet worden sein
sollen,9 gibt es eine publizierte Arbeit, die diese unter Sertindol in Purkinje-Fasern von Kaninchen beschreibt.14 Die im Mai 2005 verabschiedete
ICH*-Leitlinie E14 zur klinischen Prüfung des proarrhythmischen Potenzials neuer Arzneimittel räumt zwar ein, dass die QT-Verlängerung einen
unvollkommenen Marker für das Risiko von Herzrhythmusstörungen darstellt. Es wird aber betont, dass Arzneimittel mit ausgeprägter
Verlängerung der absoluten und korrigierten** QT(c)-Intervalle (um mehr als 20 msec im Mittel) mit erheblicher Wahrscheinlichkeit arrhythmogen
wirken.13 Eine Zunahme zumindest des korrigierten QTc-Intervalls um mehr als 20 msec im Mittel ist unter empfohlenen Sertindoldosierungen beschrieben:
unter achtwöchiger Einnahme von täglich 20 mg um durchschnittlich 26 msec im Vergleich zu 0 msec unter täglich 10 mg Haloperidol5 oder
aktuell in einer Arbeit um 21,9 msec unter durchschnittlich 16,2 mg pro Tag im Vergleich zu 1,7 msec unter durchschnittlich täglich 6,6 mg Risperidon
(RISPERDAL).15
* ICH = International Conference on Harmonisation, ein Projekt, in dem die Zulassungsbehörden der USA,
Europas und Japans sowie Vertreter der pharmazeutischen Industrie gemeinsame Empfehlungen erarbeiten, um die Zulassungsanforderungen an neue Arzneimittel
zu vereinheitlichen.
** Da das QT-Intervall mit zunehmender Herzfrequenz kleiner wird, wird die Intervalldauer (nach verschiedenen Formeln, z.B. Bazett-Formel) für die
Herzfrequenz korrigiert: QTc-Intervall.
Dafür, dass nach wie vor Bedenken wegen besonderer Kardiotoxizität bestehen, sprechen auch die jetzt für Sertindol geltenden
Verordnungsbeschränkungen und Auflagen. Sertindol ist wegen dieser Bedenken nur als Reservemittel zugelassen. Die Liste der Kontraindikationen und der
kontraindizierten Begleitmedikamente ist lang. Vor und zu Beginn der Behandlung sowie regelmäßig während der Therapie (alle drei Monate, vor und
nach jeder Dosiserhöhung sowie bei Änderung einer pharmakokinetisch relevanten Begleitmedikation) muss ein EKG abgeleitet
werden.9
Der US-amerikanischen Arzneimittelbehörde FDA reichen die bisherigen Daten für eine Zulassung offensichtlich nicht aus. Lundbeck-Chef BRAESTRUP
räumt 2005 gegenüber Analysten ein, dass die FDA weitere Untersuchungen fordert, und geht davon aus, dass es bis zu einer Einführung von
Sertindol in den USA noch Jahre dauern könnte.16
Belege für relevante Vorteile, die das potenziell erhöhte Risiko lebensbedrohlicher Herzrhythmusstörungen aufwiegen, finden wir in randomisierten
Vergleichen mit anderen Neuroleptika nicht.5,15
KOSTEN: Sertindol wird mit monatlich 174 € für täglich 16 mg auf dem Kostenniveau anderer neuerer Neuroleptika wie Risperidon
(RISPERDAL: 165 (/Monat für täglich 4 mg) angeboten. Es ist fünf- bis vierzehnfach teurer als Nachfolgeprodukte der Standardneuroleptika
Perphenazin (PERPHENAZIN NEURAXPHARM: 33 € für täglich 24 mg) und Haloperidol (HALOPER-CT: 12 €/Monat für täglich 10
mg).
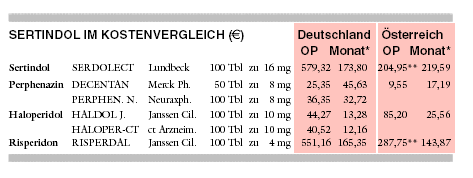
* Berechnet für eine Tagesdosis von 16 mg Sertindol, 24 mg Perphenazin, 10 mg Haloperidol bzw. 4 mg
Risperidon.
** Österreich: Preise bezogen auf 28 Tbl SERDOLECT, 60 Tbl RISPERDAL
- Das Neuroleptikum
 Sertindol (SERDOLECT), das das QT-Intervall im EKG
stärker verlängert als andere Neuroleptika, ist durch eine erhöhte Rate plötzlicher Todesfälle in Zulassungsstudien und in der
Spontanberichterfassung aufgefallen und wurde daher 1998 aus dem Handel gezogen. Sertindol (SERDOLECT), das das QT-Intervall im EKG
stärker verlängert als andere Neuroleptika, ist durch eine erhöhte Rate plötzlicher Todesfälle in Zulassungsstudien und in der
Spontanberichterfassung aufgefallen und wurde daher 1998 aus dem Handel gezogen.
- Die Entscheidung der europäischen Arzneimittelbehörde EMEA, die Vermarktungsbeschränkungen für Sertindol wieder aufzuheben,
lässt sich mangels veröffentlichter Daten nicht nachvollziehen.
- Keine der von der EMEA selbst geforderten klinischen Sicherheitsstudien ist bisher publiziert.
- Die Intransparenz der Entscheidungen dieser Behörde ist in Zeiten der evidenzbasierten Medizin, deren zentrale Säule die beurteilbare
veröffentlichte wissenschaftliche Literatur ist, ein besonderes Ärgernis.
- Da relevante Vorteile von Sertindol nicht belegt sind, beim jetzigen Kenntnisstand jedoch nach wie vor davon auszugehen ist, dass das Mittel stärker
kardiotoxisch wirkt als andere Neuroleptika, raten wir dringend von der Anwendung ab.

|


