DIMETHYLFUMARAT (TECFIDERA) GEGEN MULTIPLE SKLEROSE
Nach monatelanger Verzögerung ist die Fumarsäurezubereitung Dimethylfumarat (TECFIDERA) Anfang Februar zur peroralen Behandlung Erwachsener mit schubförmig remittierender Multipler Sklerose (MS)1 in der EU zugelassen worden.2 Zuvor hatte Anbieter Biogen erreicht, dass die europäische Arzneimittelbehörde EMA die Altsubstanz Dimethylfumarat, ein Bestandteil des Psoriasismittels FUMADERM (vgl. a-t 1997; Nr. 7: 77-8), im Präparat TECFIDERA als neuen Wirkstoff einstuft3 und der Firma somit den so genannten Unterlagenschutz garantiert. Biogen kann das Mittel daher in den nächsten zehn Jahren in der EU exklusiv vermarkten.2,4 Der Gemeinsame Bundesausschuss sieht Dimethylfumarat dagegen nicht als neuen Wirkstoff an. Eine frühe Nutzenbewertung entfällt daher.5
EIGENSCHAFTEN: Der Wirkmechanismus von Dimethylfumarat bei MS ist nicht genau geklärt. Das Mittel soll den Nrf2*-Transkriptionsweg aktivieren und auf diese Weise antioxidativ und antientzündlich wirken.6
| * | Nrf2 = Nuclear factor (erythroid-derived 2)-like 2 |
| Dosis | anfangs 7 Tage lang 2 x täglich 120 mg, dann 2 x täglich 240 mg per os, zusammen mit Mahlzeiten |
| Bioverfügbarkeit | rasche präsystemische Hydrolyse und Metabolisierung in aktiven Hauptmetaboliten Monomethylfumarat; Dimethylfumarat im Plasma nicht quantifizierbar |
| Spitzenspiegel | Monomethylfumarat: 2-2,5 Stunden |
| Verstoffwechselung | durch Esterasen und Zitronensäurezyklus |
| Ausscheidung | hauptsächlich durch Ausatmung von CO2 (60%), weniger mit dem Urin und Stuhl |
| Halbwertszeit | Monomethylfumarat: 1 Stunde |
| Wechselwirkungen | in In-vitro-Studien keine Wechselwirkung über CYP, p-Glykoprotein oder die Proteinbindung festgestellt; bei Kombination mit nephrotoxischen Mitteln mögliche Verstärkung nephrotoxischer Effekte von Dimethylfumarat; Vorsicht bei Kombination mit Immunsuppressiva oder Krebsmitteln; Kombination mit anderen Fumarsäurederivaten meiden1 |
KLINISCHE WIRSAMKEIT: An den beiden ähnlich konzipierten zulassungsrelevanten zweijährigen Phase-III-Studien (CONFIRM,7 DEFINE8) haben insgesamt 2.667 Patienten mit schubförmig remittierender MS teilgenommen. In beiden wird die zugelassene Erhaltungsdosis (2 x tgl. 240 mg per os) sowie eine nicht zugelassene höhere Dosis (3 x tgl. 240 mg per os) mit Plazebo verglichen. In CONFIRM wird in einem weiteren Arm Glatiramerazetat (COPAXONE; tgl. 20 mg s.c.) geprüft, wobei die Studie auf einen statistischen Vergleich mit dem älteren MS-Mittel nicht angelegt ist. Die Patienten sind im Mittel 37 bis 39 Jahre alt, haben seit durchschnittlich 4 bis 6 Jahren eine MS-Diagnose und einen mittleren EDSS**-Score von 2,4 bis 2,6. Etwa 30% bis 40% der Teilnehmer haben zuvor MS-Mittel wie Betainterferone verwendet.7-9
| ** | EDSS= Expanded Disability Status Scale: Skala von 0 = normaler neurologischer Befund bis 10 = Tod durch MS (vgl. a-t 2001; 32: 106) |
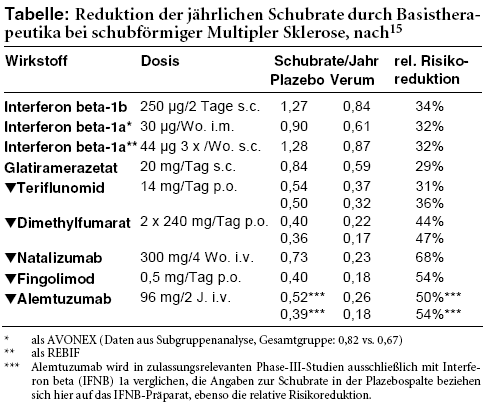
In beiden Studien mindert Dimethylfumarat das Risiko erneuter Schübe signifikant. Die jährliche Schubrate (primärer Endpunkt in CONFIRM) sinkt unter der zugelassenen Dosis von 0,407 bzw. 0,368 unter Plazebo auf 0,22 bzw. 0,17. Der Anteil der Patienten mit Schub innerhalb von zwei Jahren (primärer Endpunkt in DEFINE) wird von 41% bzw. 46% unter Scheinmedikament auf 29% bzw. 27% reduziert.7,8 Nur in der DEFINE-Studie wird das Fortschreiten von Behinderungen, die mindestens zwölf Wochen anhalten, signifikant gemindert (Rate 16% vs. 27%; Hazard Ratio [HR] 0,62; 95% Konfidenzintervall [CI] 0,44-0,87).8 In keiner Studie gibt es einen signifikanten Effekt auf das Fortschreiten von Behinderungen, die, wie von der EMA für die Nutzenbewertung gefordert,10 mindestens sechs Monate anhalten.6 Auch Glatiramerazetat mindert das Schubrisiko im Vergleich zu Plazebo signifikant (jährliche Schubrate 0,29).7 Die relative schubmindernde Wirkung von Dimethylfumarat liegt im indirekten Vergleich im Mittelfeld der verfügbaren MS-Basismittel (siehe Tabelle). Ein signifikanter Unterschied zwischen Dimethylfumarat in der zugelassenen Dosierung und Glatiramerazetat ergibt sich in einer Post-hoc-Analyse der CONFIRM-Studie nicht.7
UNERWÜNSCHTE WIRKUNGEN: Die häufigsten unerwünschten Effekte in Zulassungsstudien sind "Flushing"-Episoden mit Hitzegefühl, Hitzewallungen, Rötung, Juckreiz oder Brennen (40% [schwerwiegend: 1%] versus 6% unter Plazebo), und gastrointestinale Beschwerden wie Bauchschmerzen (18% vs. 10%), Durchfall (14% vs. 11%), Übelkeit (12% vs. 9%) und Erbrechen (9% vs. 5%). Die Störwirkungen treten besonders häufig zu Behandlungsbeginn auf und sollen sich im weiteren Verlauf bei einem Teil der Patienten bessern. 3% bzw. 4% der Patienten brechen die Behandlung wegen Flushing bzw. Magen-Darm-Störungen ab. Häufig sind auch Hautreaktionen wie Ausschlag. Gelegentlich werden Überempfindlichkeitsreaktionen beobachtet, die sich unter dem Bild einer schwerwiegenden Flushing-Episode manifestieren können, was die Patienten wissen müssen.1,9,11
Transaminasenanstieg kommt unter Dimethylfumarat häufig vor. Anstiege auf das Dreifache der oberen Norm oder höher sind jedoch nicht häufiger als unter Plazebo.1,6,9,11
Dimethylfumarat kann die Lymphozyten im Blut mindern. Im Mittel sinken die Zahlen in Zulassungsstudien um 30%. 6% der Patienten entwickeln unter der empfohlenen Dosis eine schwere Lymphopenie (< 500/µl; Plazebo < 1%). Die Rate der Infektionen (60% vs. 58%) und schwerwiegenden Infektionen (jeweils 2%) ist im Studienzeitraum zwar nicht höher als unter Scheinmedikament, und auch bei den Patienten mit Lymphopenie kommen schwere Infektionen nicht häufiger vor.1,6,9 Unter der Dimethylfumaratkombination FUMADERM bei Psoriasis sind aber inzwischen in Verbindung mit Lymphopenien schwere opportunistische Infektionen bekannt geworden, darunter mehrere Berichte über progressive multifokale Leukenzephalopathie (PML; vgl. a-t 2013; 44: 47-8). Eine PML ist unter Dimethylfumarat bei MS bislang nicht beschrieben. Vor und alle sechs bis zwölf Monate während der Behandlung muss das Blutbild überprüft werden.1 Während jedoch FUMADERM nach der seit September 2013 geltenden Fachinformation bei schwerer Lymphopenie sofort abgesetzt werden muss,12 gibt es entsprechende Vorschriften für TECFIDERA nicht. Weder in der Fachinformation zu TECFIDERA1 noch in der zu FUMADERM12 findet sich ein Hinweis auf das potenzielle PML-Risiko.
Im Tierversuch löst chronisch verabreichtes Dimethylfumarat bei vielen Spezies, darunter Hunde und Affen, auch in therapeutisch relevanten Dosierungen Nierenschäden aus. Die nephrotoxischen Effekte umfassen zum Teil irreversible tubuläre und interstitielle Schäden sowie bei Nagern auch Ausbildung benigner und maligner Tumoren.6 Trotz relativ intensiver Überwachung finden sich in den Zulassungsstudien keine klaren Anzeichen für Nierentoxizität oder Kanzerogenität. Lediglich die Häufigkeit einer Proteinurie ist mit 9% versus 7% unter Plazebo etwas erhöht.6,9 Für das Manifestwerden chronischer Schäden könnte die bisher erfasste Anwendungsdauer im Studienprogramm jedoch zu kurz sein.13 Unter Fumarsäurederivaten bei Psoriasis sind Nierenschäden seit Langem bekannt (vgl. a-t 1990, Nr. 7: 68). Die frei zugängliche UAW-Datenbank des Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) listet 30 Verdachtsberichte über Proteinurie oder Nierenversagen unter FUMADERM.14 Die Nierenfunktion muss vor und während der Therapie überwacht werden.1 Auch hier fehlt für TECFIDERA1 eine Vorschrift, wann die Therapie beendet werden muss, im Unterschied zu FUMADERM,11 das bei jedem Kreatininanstieg über die Norm abgesetzt werden muss. Unseres Erachtens sollte aus Gründen des vorbeugenden Verbraucherschutzes bei TECFIDERA sowohl im Hinblick auf das Blutbild als auch auf die Nierenwerte so vorgegangen werden wie bei FUMADERM. Biogen muss zur weiteren Klärung möglicher unerwünschter Effekte wie schwere Infektionen, Krebs oder Nierenschäden eine große 5.000 MS-Patienten umfassende Beobachtungsstudie durchführen, die über fünf Jahre laufen soll.6
KOSTEN: Biogen Idec positioniert den Preis von Dimethylfumarat (TECFIDERA) mit 2.172 € pro vier Wochen für zweimal täglich 240 mg auf dem für MS-Mittel typischen Hochniveau, etwa in der Mitte der Kosten für das Interferon-beta-1a-Präparat REBIF (1.931 €/4 Wochen für dreimal wöchentlich 44 µg) und das perorale Reservemittel Fingolimod (GILENYA; 2.325 €/4 Wochen für täglich 0,5 mg). Es verteuert die Therapie gegenüber REBIF um mehr als 10%. Im Vergleich zum Psoriasismittel FUMADERM (200 Tbl.: 624,18 €), das pro Tablette 120 mg Dimethylfumarat und 95 mg Monoethylfumaratsalze enthält, ist TECFIDERA bezogen auf die Dimethylfumaratmenge sechsfach teurer.

Mit dem Dimethylfumarat-Präparat TECFIDERA ist ein neues per os einzunehmendes Multiple-Sklerose (MS)-Mittel im Handel.
Dimethylfumarat mindert im Plazebovergleich die jährliche Schubrate bei schubförmig remittierender MS relativ um 44% bis 47%. Ein Wirkvorteil gegenüber Glatiramerazetat (COPAXONE) ist nicht belegt, direkte Vergleiche mit anderen MS-Mitteln liegen nicht vor.
Ein günstiger Einfluss auf das Fortschreiten von Behinderungen ist nicht gesichert.
Dimethylfumarat wird schlecht vertragen mit sehr häufigen Flushing-Episoden mit Hitzegefühl, Hitzewallungen, Rötung, Juckreiz oder Brennen sowie gastrointestinalen Beschwerden.
Abgesehen von häufigen schweren Lymphopenien scheint Dimethylfumarat nach den Daten der klinischen Zulassungsstudien wenig Sicherheitsprobleme zu verursachen. In Verbindung mit der schon seit den 1990er Jahren vermarkteten Dimethylfumarat-haltigen Kombination FUMADERM sind aber inzwischen opportunistische Infektionen, darunter progressive multifokale Leukenzephalopathie (PML), beschrieben. Im Tierversuch wirkt chronisch verabreichtes Dimethylfumarat zudem nierentoxisch, ein Befund, der mit den Erfahrungen mit Fumarsäurederivaten bei Psoriasis vereinbar ist. Die Zulassungsstudien mit TECFIDERA könnten zu kurz gewesen sein, um solche Schäden zu erfassen.
Wir erachten Dimethylfumarat als Reservemittel bei Unverträglichkeit oder unzureichender Wirksamkeit von Betainterferonen oder Glatiramerazetat. Anwender sollten zur Klärung der Sicherheit möglichst in Langzeitstudien eingeschlossen werden.
| (R = randomisierte Studie) | |
| 1 | Biogen Idec: Fachinformation TECFIDERA, Stand Jan. 2014 |
| 2 | VIRJI, S.: Scrip vom 4. Feb. 2014 |
| 3 | EMA: Meeting highlights vom 22. Nov. 2013 http://www.a-turl.de/?k=urmb |
| 4 | CHASE, B.: Scrip vom 23. Nov. 2013 |
| 5 | G-BA: Schreiben vom 26. Febr. 2014 |
| 6 | FDA: Med. Review TECFIDERA, März 2013; http://www.a-turl.de/?k=yrba |
| R 7 | FOX, R.J. et al.: N. Engl. J. Med. 2012; 367: 1087-97 |
| R 8 | GOLD, R. et al.: N. Engl. J. Med. 2012; 367: 1098-107 |
| 9 | EMA: Europ. Beurteilungsbericht (EPAR) TECFIDERA, Stand Nov. 2013 http://www.a-turl.de/?k=ngst |
| 10 | EMA: Guidelines on clinical investigation of medicinal products for the treatment of Multiple Sclerosis. Entwurf, Stand 20. Sept. 2012 http://www.a-turl.de/?k=undi |
| 11 | Biogen Idec: US-amerik. Produktinformation TECFIDERA, Stand März 2013; http://www.a-turl.de/?k=ebsa |
| 12 | Biogen Idec: Fachinformation FUMADERM, Stand Sept. 2013 |
| 13 | FDA: Pharmacology Review TECFIDERA, März 2013 http://www.a-turl.de/?k=rasb |
| 14 | BfArM: UAW-Datenbank, Zugriff 11. März 2014 |
| 15 | KIESEIER, B.C., STÜVE, O.: Nat. Rev. Neurol. 2011; 7: 255-62 |
© 2014 arznei-telegramm, publiziert am 14. März 2014
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
