SOFOSBUVIR (SOVALDI) GEGEN CHRONISCHE HEPATITIS C*
| * | siehe auch Blickpunkt-Artikel in a-t 2014; 45: 33-4 |
Mit dem Nukleotid-Prodrug Sofosbuvir (SOVALDI) ist erstmals ein Wirkstoff gegen chronische Hepatitis C bei Erwachsenen zugelassen, der zumindest bei einem Teil der Patienten eine Therapie ohne ein störwirkungsreiches Interferon erlauben und bei vielen Patienten die Therapiedauer verkürzen soll.1,2 Bei Hepatitis-C-Virus-Genotyp-1, der hierzulande zu 62% bei unbehandelter chronischer Hepatitis C gefunden wird,3 sowie den selteneren Genotypen 4, 5 und 6 (3,2%, 0,1%, 0,1%)3 ist allerdings primär die Dreifachkombination von Sofosbuvir mit dem Nukleosid-Analogon Ribavirin (COPEGUS, REBETOL, Generika) und Peginterferon alfa (2a: PEGASYS, 2b: PEGINTRON) für 12 Wochen zugelassen. Mit Ribavirin allein, dann aber für 24 Wochen, darf Sofosbuvir hier nur angewendet werden, wenn eine Behandlung dringend erforderlich ist und gleichzeitig Peginterferon alfa kontraindiziert ist oder Interferonunverträglichkeit besteht.1 Bei den Genotypen 2 und 3 (7% und 28% der Hepatitis-C-Infektionen)3 sowie bei Patienten mit allen Genotypen, die auf eine Lebertransplantation warten, darf die Zweifachkombination ohne diese Einschränkung verwendet werden. Bei Genotyp 2 soll zwölf Wochen, bei Genotyp 3 24 Wochen behandelt werden. Alternativ kann bei Genotyp 3 auch die Dreifachkombination für 12 Wochen verwendet werden. Insbesondere bei Vorliegen von Risikofaktoren soll allerdings bei allen Genotypen eine Verlängerung der Therapie auf 24 Wochen erwogen werden.1
EIGENSCHAFTEN: Sofosbuvir ist ein Nukleotid-Prodrug, das in der Leber in das pharmakologisch wirksame Triphosphat eines Uridin-Analogons umgewandelt wird. Mittels viraler NS5B**-Polymerase wird es als falsches Nukleosid in die Virus-RNA eingebaut. Dies führt zum Kettenabbruch. Über diesen Mechanismus soll es die für die Virusreplikation erforderliche RNA-Polymerase NS5B der Genotypen 1 bis 6 des Hepatitis-C-Virus hemmen. Humane DNA- und RNA-Polymerasen sowie die mitochondriale RNA-Polymerase werden nicht inhibiert.1,2,4
| ** | NS5B = nicht strukturelle, 5B RNA-Polymerase |
| Tagesdosis | 400 mg einmal täglich per os mit einer Mahlzeit |
| Ausscheidung | zu 78% als inaktiver Metabolit mit dem Urin |
| Halbwertszeit | 0,4 Stunden |
| Wechselwirkungen | verringerte Sofosbuvirspiegel durch starke P-Glykoprotein-Induktoren im Darm wie Rifampicin, Johanniskraut, Carbamazepin und Phenytoin1 |
WIRKSAMKEIT: In Europa wurde Sofosbuvir nach beschleunigter Bewertung zugelassen,2 in den USA die Entwicklung als potenzielle „breakthrough therapy” von der US-amerikanischen Arzneimittelbehörde FDA unterstützt.5 Mit Zustimmung der FDA wurde leider weitgehend auf Standardtherapien als Kontrollen in Phase-III-Studien verzichtet (vgl. a-t 2014; 45: 33-4).4 Primärer Endpunkt in den Zulassungsstudien ist, außer in einer Studie an Patienten, die auf eine Lebertransplantation warten, anhaltendes virologisches Ansprechen, definiert als Hepatitis-C-Virus (HCV)-RNA unterhalb der quantitativen Nachweisgrenze zwölf Wochen nach Therapieende (siehe Kasten auf der nächsten Seite).2,4
Genotypen 1, 4, 5 und 6: In der einarmigen NEUTRINO-Studie6 an 327 nicht vorbehandelten Patienten wird die Kombination von Sofosbuvir mit Ribavirin und Peginterferon alfa-2a für zwölf Wochen mit historischen Kontrollen verglichen. Die FDA begründet die Wahl eines einarmigen Studiendesigns unter anderem mit der im Vergleich zur Standardbehandlung kürzeren Therapiedauer und der fehlenden Notwendigkeit, die Therapie wie bei den Proteaseinhibitoren Boceprevir (VICTRELIS; a-t 2011; 42: 77-9) und Telaprevir (INCIVO; a-t 2011; 42: 104-7) abhängig vom Ansprechen anzupassen sowie einer 90%igen Ansprechrate in einer Phase-II-Studie.5 Zwingende Gründe für den Verzicht auf den randomisierten Vergleich gegen Therapiestandards sind dies aus unserer Sicht jedoch keineswegs. Der Einschluss von 72% der gescreenten Patienten6 scheint zumindest nicht für eine starke Selektion zu sprechen, die die Ergebnisse im indirekten Vergleich zu Gunsten der Sofosbuvir-Kombination verzerren könnte. Nach Einschätzung der europäischen Arzneimittelbehörde EMA sind die Patientencharakteristika vor Therapiebeginn ähnlich denen oder sogar weniger günstig als in den Zulassungsstudien von Telaprevir und Boceprevir an unvorbehandelten Patienten.2 Sowohl der Sofosbuvir-Anbieter als auch die FDA nehmen eine historische Ansprechrate von 60% an.5,6

Insgesamt sprechen in NEUTRINO 91% der Behandelten an (siehe Tabelle; 95% Konfidenzintervall [CI] 87-94), in der größten Gruppe mit Genotyp 1 90% (262 von 292 Patienten). Bei den seltenen Genotypen 4, 5 und 6 sind es insgesamt 97%, jedoch auf der Basis so weniger Patienten (27 von 28, 1 von 1 bzw. 6 von 6),2 dass der Polymerasehemmer in den USA bei Genotyp 5 und 6 nicht zugelassen ist.5 Sofosbuvir plus Ribavirin allein ist bei therapienaiven Patienten mit Genotyp 1 in einer Phase-III-Studie nur als Subgruppe bei Koinfektion mit HIV-1 untersucht (siehe unten).2,4
Für vorbehandelte Patienten mit den Genotypen 1, 4, 5 und 6 fehlen Phase-III-Studien mit Sofosbuvir. Laut Fachinformation ist dennoch zu erwägen, diese mit der Dreifachkombination zu behandeln.1
Genotypen 2 und 3: Hier erweist sich in der offenen randomisierten FISSION-Studie6 die 12-wöchige Interferon-freie Therapie mit Sofosbuvir plus Ribavirin bei 499 nicht vorbehandelten Patienten gegenüber Standardtherapie mit Peginterferon alfa-2a plus Ribavirin für 24 Wochen als nicht unterlegen, jedoch nicht als überlegen.4 Anhaltendes virologisches Ansprechen wird in beiden Gruppen bei 67% erreicht (Differenz 0,3%; 95% Konfidenzintervall [CI] .7,5-8%), wobei Genotyp 2 deutlich besser auf die Therapie anspricht als Genotyp 3 (siehe Tabelle auf der vorherigen Seite).2 Ähnlich wirksam ist die Zweifachkombination in der plazebokontrollierten doppelblinden randomisierten POSITRON-Studie7 bei 278 Patienten mit Interferonunverträglichkeit oder -kontraindikation oder solchen, die eine Interferontherapie ablehnen (78%; 95% CI 72-83% vs. 0% unter Plazebo).2
BEGRÜNDUNG FÜR VERKÜRZTE NACHBEOBACHTUNG IN SOFOSBUVIR-STUDIEN
Zur Beurteilung der Wirksamkeit von Hepatitis-C-Medikamenten wird bei der Zulassung anhaltendes virologisches Ansprechen als Surrogatparameter für das Fortschreiten der Erkrankung herangezogen.1 Es ist mit Verhinderung von hepatozellulären Karzinomen und Senkung der Mortalität assoziiert.2-4 Bislang wurde dieser Endpunkt von der Arzneimittelbehörde EMA definiert als nicht nachweisbare HCV-RNA 24 Wochen nach Therapieende.1 Für Sofosbuvir wird jetzt eine Nachbeobachtung von nur zwölf Wochen akzeptiert. Nach einer unter der Mitwirkung von FDA-Mitarbeitern durchgeführten Analyse von 15 klinischen Studien mit insgesamt 13.599 Erwachsenen wird bei 98% der Patienten mit Genotyp 1 und virologischem Ansprechen nach 12 Wochen auch nach 24 Wochen keine HCV-RNA nachgewiesen (positiv prädiktiver Wert). Bei gemeinsamer Auswertung von Genotyp 2 und 3 ergibt sich ein positiv prädiktiver Wert von 99%.5 Basierend auf vorhandenen Daten ist der positiv prädiktive Wert für Kombinationen mit Sofosbuvir ähnlich hoch.6,7
| 1 | EMA: Guideline on the clinical evaluation of direct acting antiviral agents intended for treatment of chronic hepatitis C. April 2009; http://www.a-turl.de/?k=eilm |
| 2 | van der MEER, A.J. et al.: JAMA 2012; 308: 2584-93 |
| 3 | McCOMBS, J. et al.: JAMA Intern. Med. 2014; 174: 204-12 |
| 4 | SINGAL, A.G. et al.: Clin. Gastroenterol. Hepatol. 2010; 8: 280-8 |
| 5 | CHEN, J. et al.: Gastroenterology 2013; 144: 1450-5 |
| 6 | FDA: Medical Review SOVALDI, Nov. 2013 http://www.a-turl.de/?k=ubst |
| 7 | Gilead Sciences: Briefing Document Sofosbuvir, 25. Okt. 2013 http://www.a-turl.de/?k=ormi |
Bei vorbehandelten Patienten mit Versagen auf eine Interferon-haltige Therapie wirkt die 16-wöchige Einnahme der Zweifachkombination in der doppelblinden randomisierten FUSION-Studie7 an 201 Patienten besser als 12-wöchige mit Ansprechen bei 71% vs. 50% bei gemeinsamer Auswertung von Genotyp 2 und 3.2 Beide Raten liegen signifikant über 25%, die nach Empfehlung der FDA für die historischen Kontrollen angenommen werden.7 Die Ansprechrate steigt insbesondere bei Genotyp 3 mit längerer Anwendung an (siehe Tabelle). In die gleiche Richtung weist die nicht kontrollierte, bislang unveröffentlichte VALENCE-Studie, in der nach 24 Wochen Therapie bei Genotyp 3 93% der 105 therapienaiven und 77% der 145 vorbehandelten Patienten unter Sofosbuvir plus Ribavirin ansprechen. Von den Behörden wird diese Studie als Begründung für die Zulassung einer 24-wöchigen Behandlung mit der Zweifachkombination bei Genotyp 3 angeführt.2,4 Für die ebenfalls zulässige Therapie mit der Dreifachkombination für 12 Wochen bei Genotyp 3 liegen nur Phase-II- bzw. explorative Daten vor.1
Koinfektion: In der noch laufenden offenen nicht randomisierten Phase-III-Studie PHOTON-1 werden 210 Patienten untersucht, die mit HIV-1 koinfiziert sind. Bei therapienaiven Patienten mit Hepatitis-C-Virus vom Genotyp 1 sowie Vor-behandelten und Nichtvorbehandelten mit Genotyp 2 und 3 werden unter Sofosbuvir plus Ribavirin Ansprechraten von 75% bis 93% erreicht (siehe Tabelle).4 Die Therapieschemata sind gemäß Fachinformation bei HIV die gleichen wie für Patienten ohne HIV, beispielsweise ist primär die Dreifachkombination bei Genotyp 1 vorgesehen. Zur Anwendung bei Hepatitis-B-Koinfizierten fehlen Studien.1
Patienten, die auf eine Lebertransplantation warten: Für diese Patienten, bei denen ohne Therapie nach Transplantation nahezu immer ein Rezidiv der Hepatitis C auftritt, liegt lediglich die Zwischenauswertung einer laufenden Phase-II-Studie an Patienten mit hepatozellulärem Karzinom und vorgesehener Transplantation innerhalb eines Jahres vor. Die Ansprechrate soll dort 62% betragen (P7977-2025, siehe Tabelle).2,4
UNERWÜNSCHTE WIRKUNGEN: Weder EMA noch FDA haben spezifische Störwirkungen von Sofosbuvir entdeckt,2,4 was daran liegen könnte, dass Kontrollgruppen weitgehend fehlen und indirekte Vergleiche schwierig sind. Im direkten Vergleich mit Peginterferon alfa-2a plus Ribavirin sind unter Sofosbuvir plus Ribavirin typische Störwirkungen des Interferons seltener, beispielsweise Müdigkeit (55% versus 36%), Kopfschmerzen (44% vs. 25%), Übelkeit (29% vs. 18%), grippeähnliche Beschwerden (18% vs. 3%) und Depression (14% vs. 5%).6 Dies trifft auch für schwere Störwirkungen (19% vs. 7%) zu, darunter Neutropenie (bei gepoolter Auswertung 3,3% vs. 0%), sowie solche, die zur Beendigung der Therapie führen (11% vs. 1%). Eine 24-wöchige Behandlung mit Sofosbuvir plus Ribavirin scheint das Störwirkungspotenzial gegenüber 12-wöchiger Therapie nicht zu erhöhen.4
2013 hatte Bristol-Myers Squibb die Entwicklung eines mit Sofosbuvir strukturell nicht verwandten NS5B-Polymerase-Hemmers eingestellt, nachdem in einer Studie neun Patienten hospitalisiert werden mussten und einer an Herzversagen verstarb. Seitens der FDA wurden deshalb die Daten von Sofosbuvir detailliert hinsichtlich Kardiotoxizität geprüft. Ein Risikosignal wurde nicht entdeckt.4
EMPFEHLUNGEN: Aktualisierte Empfehlungen der American Association for the Study of Liver Diseases (AASLD) und der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS) sehen Sofosbuvir-haltige Therapien für alle Genotypen als erste Wahl vor. Telaprevir und Boceprevir sollen unter anderem wegen ihrer Risiken bei Genotyp 1 nicht mehr angewendet werden.8,9 Die DGVS empfiehlt allerdings, bereits jetzt bei der Beratung von Patienten zu berücksichtigen, dass in diesem Jahr mit Zulassung weiterer Hepatitis-C-Medikamente zu rechnen ist, die die Therapieoptionen erweitern und Interferon-freie Therapien für alle Genotypen ermöglichen sollen.8
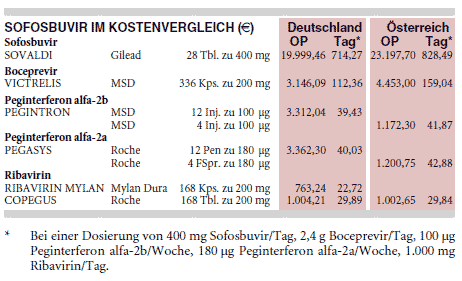
KOSTEN: Allein die Einnahme von täglich 400 mg Sofosbuvir (SOVALDI) für 12 Wochen kostet bereits 60.000 € und verteuert die Therapie der Hepatitis C erheblich. Bei Genotyp 1 ist die Dreifachkombination mit Ribavirin (COPEGUS) und Peginterferon alfa-2a (PEGASYS) für 12 Wochen bis zu 112% teurer als die Behandlung mit Ribavirin (REBETOL, Generika) und Peginterferon alfa-2b (PEGINTRON) plus Boceprevir (VICTRELIS; 65.871 € vs. 31.057 € bei täglich 400 mg Sofosbuvir, 1 g Ribavirin und wöchentlich 180 µg Peginterferon alfa-2a im Vergleich zu 28 Wochen lang einmal täglich 1 g eines günstigen Ribavirin-Generikums, einmal wöchentlich 100 µg Peginterferon alfa-2b und 24 Wochen täglich 2,4 g Boceprevir bei Frühansprechern).
Bei Genotyp 3 steigen die Arzneimittelkosten für Sofosbuvir plus Ribavirin gegenüber Ribavirin plus Peginterferon alfa-2b jeweils für 24 Wochen auf mehr als das 11-Fache (125.018 € bei täglich 400 mg Sofosbuvir plus 1 g Ribavirin im Vergleich zu 10.741 € bei täglich 800 mg Ribavirin plus wöchentlich 180 µg Peginterferon alfa-2a).***
| *** | Die Kosten für die Herstellung von 84 Tabletten Sofosbuvir (ausreichend für eine 12-wöchige Behandlung) werden bei Massenproduktion auf 49 € (68 $) bis 99 € (136 $) geschätzt.10 Für Indien soll der Anbieter einen Preis von etwa 1.450 € (2.000 $) für eine 24-wöchige Behandlung vorsehen.11 |
Mit dem Polymerasehemmer Sofosbuvir (SOVALDI) werden bei Erwachsenen mit chronischer Hepatitis C in Kombinationstherapien möglicherweise höhere anhaltende virologische Ansprechraten erreicht als unter bisher verfügbaren Therapien. Gleichzeitig wird für viele Patienten eine Verkürzung der Therapiedauer möglich und bei einigen eine Behandlung ohne Interferone.
Mit Zustimmung der US-amerikanischen Arzneimittelbehörde FDA wurde in den Zulassungsstudien allerdings weitgehend auf Vergleiche mit bisherigen Standardtherapien verzichtet, sodass sich der Stellenwert des Mittels nur eingeschränkt beurteilen lässt (vgl. a-t 2014; 45: 33-4).
Im direkten Vergleich von Sofosbuvir plus Ribavirin (COPEGUS, REBETOL, Generika) mit Peginterferon alfa-2a (PEGASYS) plus Ribavirin sind Störwirkungen, auch schwere, seltener. Risikosignale wurden nicht entdeckt.
Sofosbuvir verursacht hohe Kosten, insbesondere im Vergleich zur Zweifachkombination aus Ribavirin plus Peginterferon alfa.
Trotz der Unsicherheiten hinsichtlich Nutzen und Risiken halten wir die Anwendung von Sofosbuvir aus Verträglichkeitsgründen für vertretbar. Vor einer Therapie sollten Patienten aber über den unzureichenden Kenntnisstand informiert werden.
| (R =randomisierte Studie) | |
| 1 | Gilead Science: Fachinformation SOVALDI, Stand Jan. 2014 |
| 2 | EMA: Europ. Beurteilungsbericht (EPAR) SOVALDI, Stand Nov. 2013 http://www.a-turl.de/?k=oose |
| 3 | HÜPPE, D. et al.: Z. Gastroenterol. 2008; 46: 34-44 |
| 4 | FDA: Medical Review SOVALDI, Nov. 2013; http://www.a-turl.de/?k=ubst |
| 5 | FDA: Summary Review SOVALDI, Nov. 2013 http://www.a-turl.de/?k=raup |
| R 6 | LAWITZ, E. et al.: N. Engl. J. Med. 2013; 368: 1878-87 |
| R 7 | JACOBSON, I.M. et al.: N. Engl. J. Med. 2013; 368: 1867-77 |
| 8 | DGVS: Aktuelle Empfehlungen des DGVS zur Therapie der chronischen Hepatitis C, ohne Datum, Zugriff Apr. 2014 ; http://www.a-turl.de/?k=alsh |
| 9 | AASLD: Recommendation for Testing, Managing and Treating Hepatitis C, März 2014; http://www.a-turl.de/?k=eisw |
| 10 | HILL, A. et al.: Clin. Infect. Dis. 2014; 58: 928-36 |
| 11 | JYOTHI DATTA, P.T.: The Hindu Business Line, 3. Febr. 2014 http://a-turl.de/?k=iesa |
© 2014 arznei-telegramm, publiziert am 11. April 2014
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
