"Aggressives Marketing durch Merck & Co. mit wiederholten Episoden der Selbstgefälligkeit von Zulassungsbehörden" - so kommentiert ein Editorial im Lancet Entwicklungen, die zur Marktrücknahme des Cox-2-Hemmers Rofecoxib (VIOXX) geführt haben (Editorial: Lancet 2004; 364: 1287-8). Wie sich der Kenntnisstand zu Nutzen und Schaden der Coxibe seit Markteinführung des ersten Coxibs entwickelt hat, beschreiben wir in nachfolgender Dokumentation.
Texte, die nicht Rofecoxib, sondern hauptsächlich andere Cox-2-Hemmer betreffen, sind in kleinerer Schrift gedruckt. Ein Hinweis zu den genannten Herstellern: Rofecoxib wurde in den USA von Merck & Co. hergestellt (eine Firma, die ursprünglich von E. Merck, Deutschland, abstammt, jedoch seit dem 1. Weltkrieg davon unabhängig ist). Die deutsche Merck & Co.-Tochter ist MSD. Zulassungsinhaber von Celecoxib ist Pharmacia. Seit dem Zusammenschluss 2003 gehört Pharmacia zum Pfizer-Konzern, in dem beispielsweise auch Searle, Mack (Illert.), Parke-Davis u.a. aufgegangen sind.
ROFECOXIB (VIOXX) U.A.: AUFSTIEG UND NIEDERGANG VON COX-2-HEMMERN
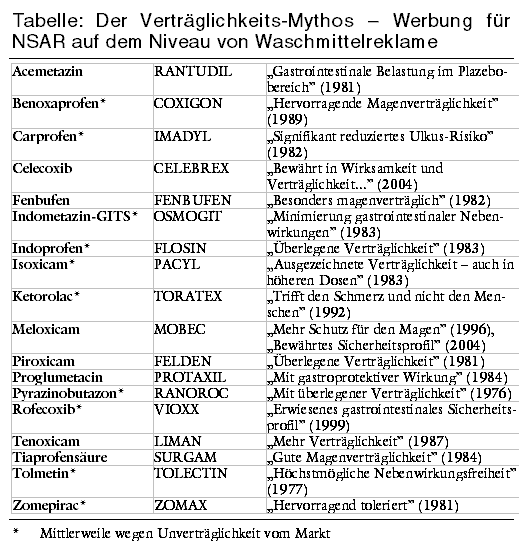
Seit Jahrzehnten wird für neu in den Handel gebrachte nichtsteroidale Antirheumatika (NSAR) besondere Verträglichkeit versprochen, vor allem "Magenverträglichkeit" - und seit Jahrzehnten folgt regelmäßig die Ernüchterung. Viele der in der Werbung als besonders verträglich bezeichneten Präparate mussten inzwischen wegen Unverträglichkeit aus dem Handel gezogen werden. Als Flop erwiesen sich beispielsweise galenische Varianten wie die GITS-Kapseln, die Lötlampen-ähnliche Löcher im Magen-Darm-Trakt verursacht haben (OSMOGIT u.a.) oder Molekülverbindungen wie das angeblich gastroprotektive Proglumetazin (Indometazin + Proglumid: PROTAXIL, s. Tabelle). Auch Cox-2-Hemmer erfüllen nicht die Erwartungen.
Alle NSAR haben einen gemeinsamen Wirkmechanismus: Sie hemmen Cyclooxygenasen (Cox). Zwei Isoenzyme sind bekannt, die von allen NSAR, einschließlich Coxiben, mit unterschiedlicher Selektivität gehemmt werden. Während Cox 1 Botenstoffe für physiologische Prozesse wie Schutz der Magenschleimhaut, Nierendurchblutung oder Thrombozytenaggregation reguliert, wird Cox 2 unter anderem bei Entzündungen neu gebildet, besitzt jedoch auch physiologische Bedeutung, beispielsweise in den Nieren. Hemmung von Cox wirkt sich daher keineswegs nur günstig aus. Es fehlen zudem die klinischen Belege für die Hypothese, dass Cox-2-selektive NSAR generell besser Magen-Darm-verträglich sind als nichtselektive NSAR.
 Mai 1996: "Bevorzugte Cox-2-Hemmung" lautet die Zauberformel für Meloxicam (MOBEC). Die Belege für Meloxicam sind bei Markteinführung jedoch dürftig: Aus den "veröffentlichten Daten können wir keine ernstzunehmenden Belege für einen klinischen Vorteil gegenüber Vergleichspräparaten ableiten" (a-t 1996; Nr. 8: 77-8). Die irreführende Werbung "mehr Schutz für den Magen", die den Sachverhalt für ein potenziell magenschädigendes NSAR auf den Kopf stellt, muss Thomae nach einstweiliger Verfügung eines anderen NSAR-Anbieters unterlassen (a-t 1997; Nr. 9: 98-9). Mai 1996: "Bevorzugte Cox-2-Hemmung" lautet die Zauberformel für Meloxicam (MOBEC). Die Belege für Meloxicam sind bei Markteinführung jedoch dürftig: Aus den "veröffentlichten Daten können wir keine ernstzunehmenden Belege für einen klinischen Vorteil gegenüber Vergleichspräparaten ableiten" (a-t 1996; Nr. 8: 77-8). Die irreführende Werbung "mehr Schutz für den Magen", die den Sachverhalt für ein potenziell magenschädigendes NSAR auf den Kopf stellt, muss Thomae nach einstweiliger Verfügung eines anderen NSAR-Anbieters unterlassen (a-t 1997; Nr. 9: 98-9).
 November 1999: MSD bringt Rofecoxib (VIOXX), den ersten "selektiven" Cox-2-Hemmer, auf den Markt. Nutzen und Risiken des Coxibs sind bei Markteinführung unzureichend dokumentiert. In Vergleichsstudien zur Verträglichkeit werden konventionelle NSAR ohne therapeutische Erfordernis maximal dosiert, sodass dosisabhängige gastrointestinale Störwirkungen in Kauf genommen werden und die Prüfsubstanz Rofecoxib besser abschneidet. Unser Kommentar: "Dennoch lässt sich ein Vorteil bei klinisch relevanten gastrointestinalen Störwirkungen kaum nachweisen. Das Ganze empfinden wir als gezielte Irreführung" (a-t 1999; Nr. 12: 123-4). November 1999: MSD bringt Rofecoxib (VIOXX), den ersten "selektiven" Cox-2-Hemmer, auf den Markt. Nutzen und Risiken des Coxibs sind bei Markteinführung unzureichend dokumentiert. In Vergleichsstudien zur Verträglichkeit werden konventionelle NSAR ohne therapeutische Erfordernis maximal dosiert, sodass dosisabhängige gastrointestinale Störwirkungen in Kauf genommen werden und die Prüfsubstanz Rofecoxib besser abschneidet. Unser Kommentar: "Dennoch lässt sich ein Vorteil bei klinisch relevanten gastrointestinalen Störwirkungen kaum nachweisen. Das Ganze empfinden wir als gezielte Irreführung" (a-t 1999; Nr. 12: 123-4).
Durch Hemmung von Cox 2 wird die Bildung von Prostazyklinen gehemmt, und damit deren günstige vasodilatatorische und antiaggregatorische Effekte, nicht jedoch die Bildung des gerinnungsfördernden Thromboxan A2. Da Cox 2 eine Rolle als Gegenspieler prothrombotischer Reaktionen am Gefäßendothel der großen Gefäße spielt, geben wir zu bedenken: "Nicht auszuschließen ist, dass thrombotische Ereignisse bei Personen mit kardiovaskulären Erkrankungen unter der Behandlung mit Rofecoxib zunehmen, ebenso wie Erkrankungen beziehungsweise Versagen der Nieren" (a-t 1999; Nr. 12: 123-4).
Die Werbung für VIOXX bei Markteinführung erscheint neutral: "Das erste Medikament, das Cox 2 hemmt, aber nicht Cox 1" (MSD: VIOXX-Werbung in Ärzte Ztg. vom 3. Dez. 1999). Die Beeinflussung der Verordner überlässt MSD im Wesentlichen habilitierten Pharmareferenten, die beispielsweise über Funktionen in der Deutschen Gesellschaft für Rheumatologie für Multiplikatoreffekte sorgen. Die von den Firmen beschäftigten Rheumatologen verbreiten den Mythos der besonderen Verträglichkeit. Dominierende Botschaft ist: "so verträglich wie Plazebo" (z.B. Ärzte Ztg. vom 16. Juni 1999).
 Januar 2000: Nach Angaben einer MSD-Mitarbeiterin durchläuft Rofecoxib "das größte klinische Untersuchungsprogramm", das die Firma "jemals mit einer Substanz vorgenommen" habe (Ärzte Ztg. vom 26. Jan. 2000, Seite 12). Auf der zitierten Seite der Ärzte Ztg. finden wir gleich dreimal die Behauptung, dass nach Angabe von MSD in den Studien "die Raten der klinisch relevanten Nebenwirkungen" bzw. "schwerwiegende gastrointestinale Nebenwirkungen" von Rofecoxib "auf Plazebo-Niveau" liegen. Januar 2000: Nach Angaben einer MSD-Mitarbeiterin durchläuft Rofecoxib "das größte klinische Untersuchungsprogramm", das die Firma "jemals mit einer Substanz vorgenommen" habe (Ärzte Ztg. vom 26. Jan. 2000, Seite 12). Auf der zitierten Seite der Ärzte Ztg. finden wir gleich dreimal die Behauptung, dass nach Angabe von MSD in den Studien "die Raten der klinisch relevanten Nebenwirkungen" bzw. "schwerwiegende gastrointestinale Nebenwirkungen" von Rofecoxib "auf Plazebo-Niveau" liegen.
 März 2000: Hinweise auf ein kardiovaskuläres Schädigungspotenzial von Rofecoxib lassen in den USA die Aktienkurse des US-Herstellers Merck & Co. fallen. Weil ein Gruppeneffekt der Coxibe diskutiert wird, geben auch die Kurse des Celecoxib-Anbieters Pharmacia nach (Scrip 2000; Nr. 2536/37: 28). März 2000: Hinweise auf ein kardiovaskuläres Schädigungspotenzial von Rofecoxib lassen in den USA die Aktienkurse des US-Herstellers Merck & Co. fallen. Weil ein Gruppeneffekt der Coxibe diskutiert wird, geben auch die Kurse des Celecoxib-Anbieters Pharmacia nach (Scrip 2000; Nr. 2536/37: 28).
Die US-amerikanische Produktinformation von Rofecoxib muss korrigiert werden. Neben Angaben zu Nebenwirkungen wie Ösophagusgeschwür, Magengeschwür und Magenperforation finden sich jetzt auch Hinweise auf Herzinfarkt, instabile Angina, zerebrovaskuläre Ereignisse, transitorische ischämische Attacken (TIA) u.a. (FDA: Medwatch 17. März 2000). Nebenwirkungen wie instabile Angina pectoris und TIA sind in der deutschen VIOXX-Fachinformation selbst 2004 noch nicht deklariert (siehe Mai 2004).
 April 2000: Nach vorläufigen Daten der VIGOR*-Studie kommen Herzinfarkte unter dem Cox-2-Hemmer deutlich häufiger vor als unter Naproxen (PROXEN u.a.). MSD verschleiert die Befunde: Die häufigeren Herzinfarkte zeugten angeblich nicht von einer spezifischen Schädlichkeit des Rofecoxib, sondern von einem kardioprotektiven Effekt des Naproxen (Merck & Co. [USA]: Pressemitteilung vom 28. Apr. 2000). Für einen kardioprotektiven Effekt von Naproxen fehlt aber der Beleg (a-t 2000; 31: 46). Die Firma wird später wegen dieser "irreführenden" Behauptungen von der FDA abgemahnt (siehe September 2001). April 2000: Nach vorläufigen Daten der VIGOR*-Studie kommen Herzinfarkte unter dem Cox-2-Hemmer deutlich häufiger vor als unter Naproxen (PROXEN u.a.). MSD verschleiert die Befunde: Die häufigeren Herzinfarkte zeugten angeblich nicht von einer spezifischen Schädlichkeit des Rofecoxib, sondern von einem kardioprotektiven Effekt des Naproxen (Merck & Co. [USA]: Pressemitteilung vom 28. Apr. 2000). Für einen kardioprotektiven Effekt von Naproxen fehlt aber der Beleg (a-t 2000; 31: 46). Die Firma wird später wegen dieser "irreführenden" Behauptungen von der FDA abgemahnt (siehe September 2001).
* |
VIGOR = VIOXX Gastrointestinal Outcome Research
|
 Mai 2000: Analysten sind von der Erklärung der Firma nicht überzeugt. Ein skeptischer Kommentar: "Mit Herzinfarkten und Schlaganfällen werden die Risiken von VIOXX in einem Bereich erweitert, den die meisten Menschen nicht in Betracht ziehen." Die FDA will die Daten prüfen, erachtet VIOXX jedoch weiterhin als "effective and adequately safe" (Reuters Medical News vom 5. Mai 2000). Mai 2000: Analysten sind von der Erklärung der Firma nicht überzeugt. Ein skeptischer Kommentar: "Mit Herzinfarkten und Schlaganfällen werden die Risiken von VIOXX in einem Bereich erweitert, den die meisten Menschen nicht in Betracht ziehen." Die FDA will die Daten prüfen, erachtet VIOXX jedoch weiterhin als "effective and adequately safe" (Reuters Medical News vom 5. Mai 2000).
Pfizer bringt  Celecoxib (CELEBREX), den zweiten Cox-2-Hemmer, auf den Markt - für die "Rheumatherapie ohne Reue" (CELEBREX-Werbung: Ärzte Ztg. vom 29. Mai 2000). Auf der Basis veröffentlichter Daten ist bei Markteinführung nur belegt, dass die Neuerung Beschwerden bei Arthrose und rheumatoider Arthritis besser lindert als Plazebo. Der Stellenwert im Vergleich zu bewährten NSAR bleibt dagegen offen. Die behauptete bessere Verträglichkeit lässt sich anhand der veröffentlichten Daten nicht nachvollziehen: Wie bei Rofecoxib (siehe November 1999) werden durch ungerechtfertigt hohe Dosierungen der Vergleichs-NSAR gastrointestinale Schäden provoziert. Eine hohe Rate an Hautausschlägen fällt auf: Celecoxib besitzt Sulfonamid-Struktur (a-t 2000; 31: 50-1). Celecoxib (CELEBREX), den zweiten Cox-2-Hemmer, auf den Markt - für die "Rheumatherapie ohne Reue" (CELEBREX-Werbung: Ärzte Ztg. vom 29. Mai 2000). Auf der Basis veröffentlichter Daten ist bei Markteinführung nur belegt, dass die Neuerung Beschwerden bei Arthrose und rheumatoider Arthritis besser lindert als Plazebo. Der Stellenwert im Vergleich zu bewährten NSAR bleibt dagegen offen. Die behauptete bessere Verträglichkeit lässt sich anhand der veröffentlichten Daten nicht nachvollziehen: Wie bei Rofecoxib (siehe November 1999) werden durch ungerechtfertigt hohe Dosierungen der Vergleichs-NSAR gastrointestinale Schäden provoziert. Eine hohe Rate an Hautausschlägen fällt auf: Celecoxib besitzt Sulfonamid-Struktur (a-t 2000; 31: 50-1).
 September 2000: Das britische Committee on Safety of Medicines (CSM) wertet 1.120 Meldungen zu unerwünschten Wirkungen von Rofecoxib seit Markteinführung bis Juli 2000 aus, darunter 8 Todesfälle. Jeder zweite Bericht betrifft den Magen-Darm-Trakt. Überwiegend (84%) handelt es sich dabei um NSAR-typische Beschwerden einschließlich gastrointestinaler Geschwüre, Durchbrüche oder Blutungen. 177 Ereignisse (16%) beziehen sich auf das Herz-Kreislauf-System: Ödeme (N = 101), Hypertonie (31), Palpitationen (19), Herzinsuffizienz (15) und Myokardinfarkt (9, darunter 3 Todesfälle; Current Problems in Pharmacovigilance 2000; 26: 13). MSD münzt diese Berichte in einer Pressemitteilung in "gutes Sicherheitsprofil" um. Perforationen, Ulzera und Blutungen (PUB) seien angeblich "deutlich seltener ... als in der Normalbevölkerung, die keine NSAR einnimmt" (MSD, zitiert nach Dtsch. Apoth. Ztg. 2000; 140: 4461). Das von der Firma errechnete geringe Risiko lässt unberücksichtigt, dass nur ein Bruchteil aufgetretener Nebenwirkungen tatsächlich gemeldet wird. Auf eine Meldung kommen mindestens 20 nicht berichtete Ereignisse (Dunkelziffer). "Statt der von MSD errechneten 0,068%igen Häufigkeit von PUB gehen wir von mindestens 1% aus" (a-t 2000; 31: 86). September 2000: Das britische Committee on Safety of Medicines (CSM) wertet 1.120 Meldungen zu unerwünschten Wirkungen von Rofecoxib seit Markteinführung bis Juli 2000 aus, darunter 8 Todesfälle. Jeder zweite Bericht betrifft den Magen-Darm-Trakt. Überwiegend (84%) handelt es sich dabei um NSAR-typische Beschwerden einschließlich gastrointestinaler Geschwüre, Durchbrüche oder Blutungen. 177 Ereignisse (16%) beziehen sich auf das Herz-Kreislauf-System: Ödeme (N = 101), Hypertonie (31), Palpitationen (19), Herzinsuffizienz (15) und Myokardinfarkt (9, darunter 3 Todesfälle; Current Problems in Pharmacovigilance 2000; 26: 13). MSD münzt diese Berichte in einer Pressemitteilung in "gutes Sicherheitsprofil" um. Perforationen, Ulzera und Blutungen (PUB) seien angeblich "deutlich seltener ... als in der Normalbevölkerung, die keine NSAR einnimmt" (MSD, zitiert nach Dtsch. Apoth. Ztg. 2000; 140: 4461). Das von der Firma errechnete geringe Risiko lässt unberücksichtigt, dass nur ein Bruchteil aufgetretener Nebenwirkungen tatsächlich gemeldet wird. Auf eine Meldung kommen mindestens 20 nicht berichtete Ereignisse (Dunkelziffer). "Statt der von MSD errechneten 0,068%igen Häufigkeit von PUB gehen wir von mindestens 1% aus" (a-t 2000; 31: 86).
Vier Monate nach Markteinführung von Celecoxib erscheint die CLASS**-Studie, die 8.000 Patienten einbezieht. Glaubt man der Veröffentlichung, die unter den Namen von sechs Pharmacia-Angestellten und zehn bezahlten Beratern der Firma publiziert wird, scheinen Tagesdosierungen von 400 mg Celecoxib im Vergleich zu 150 mg Diclofenac oder 2.400 mg Ibuprofen das relative Risiko einer Ulkuskomplikation bezogen auf ein Jahr auf die Hälfte zu reduzieren (von 1,45% auf 0,76%). Statistische Signifikanz wird jedoch nur für die Untergruppe derjenigen Patienten erzielt, die nicht zusätzlich niedrig dosierte ASS einnehmen (a-t 2000; 31: 91-2, 97). Erst später wird deutlich, dass die für Celecoxib positive Ergebnisdarstellung in CLASS nur durch Hochrechnungen der günstigeren Halbjahresergebnisse vorgetäuscht wurden, obwohl die ungünstigen Jahresdaten bei Veröffentlichung der Studie längst vorlagen (siehe August 2001).
** |
CLASS = Celecoxib Long-term Arthritis Safety Study
|
 November 2000: Ein Jahr nach Markteinführung von Rofecoxib wird die VIGOR-Studie veröffentlicht (BOMBARDIER, C. et al.: N. Engl. J. Med. 2000; 343: 1520-8). 8.076 Patienten mit rheumatoider Arthritis nehmen neun Monate lang entweder 50 mg Rofecoxib oder 1.000 mg Naproxen ein. Unter diesen Hochdosierungen werden unter Rofecoxib seltener Magen-Darm-Komplikationen beschrieben als unter Naproxen (1,4% versus 3%). Mehr Personen erleiden jedoch einen Herzinfarkt (0,4% versus 0,1%). Die Autoren und MSD halten an der bereits zuvor geäußerten Fehlinterpretation (siehe April 2000) fest, dass der Unterschied nicht darauf beruhe, dass Rofecoxib kardiotoxisch, sondern dass Naproxen kardioprotektiv wirke. Die erhöhte Rate von Myokardinfarkten betreffe zudem lediglich die 4% der Studienpatienten, die wegen Vorerkrankung eigentlich ASS hätten einnehmen müssen, was aber durch das Studiendesign ausgeschlossen ist (a-t 2000; 31: 107). Erst später wird klar, dass in der Veröffentlichung relevante Daten zur Beurteilung der Verträglichkeit von Rofecoxib unterschlagen wurden (siehe August 2001). November 2000: Ein Jahr nach Markteinführung von Rofecoxib wird die VIGOR-Studie veröffentlicht (BOMBARDIER, C. et al.: N. Engl. J. Med. 2000; 343: 1520-8). 8.076 Patienten mit rheumatoider Arthritis nehmen neun Monate lang entweder 50 mg Rofecoxib oder 1.000 mg Naproxen ein. Unter diesen Hochdosierungen werden unter Rofecoxib seltener Magen-Darm-Komplikationen beschrieben als unter Naproxen (1,4% versus 3%). Mehr Personen erleiden jedoch einen Herzinfarkt (0,4% versus 0,1%). Die Autoren und MSD halten an der bereits zuvor geäußerten Fehlinterpretation (siehe April 2000) fest, dass der Unterschied nicht darauf beruhe, dass Rofecoxib kardiotoxisch, sondern dass Naproxen kardioprotektiv wirke. Die erhöhte Rate von Myokardinfarkten betreffe zudem lediglich die 4% der Studienpatienten, die wegen Vorerkrankung eigentlich ASS hätten einnehmen müssen, was aber durch das Studiendesign ausgeschlossen ist (a-t 2000; 31: 107). Erst später wird klar, dass in der Veröffentlichung relevante Daten zur Beurteilung der Verträglichkeit von Rofecoxib unterschlagen wurden (siehe August 2001).
Wegen "umfangreicher finanzieller Verquickungen" der Autoren fehlt in der Printversion der VIGOR-Studie im New England Journal of Medicine die übliche detaillierte Deklaration der Interessenkonflikte. Diese sei wegen des Umfangs "unpraktikabel" und werde nur im Internet dargestellt. 11 der 13 Hauptautoren haben finanzielle Verbindungen mit Merck & Co., die beiden anderen sind Angestellte der Firma. Wer heute die Studie aus dem Internet ausdruckt, erhält zwar umfangreiche Angaben zu den finanziellen Verbindungen der 11 Autoren zu Merck. Der Hinweis, dass 2 Autoren Angestellte sind, fehlt jedoch (Ausdruck am 18. Okt. 2004).
 Dezember 2000: VIOXX ist ein Jahr nach Markteinführung bereits auf Rang 71 der meistverordneten Arzneimittel aufgerückt (siehe Dezember 2003), nicht zuletzt wegen des Marketings, das auf intensive Beschäftigung "habilitierter Pharmareferenten" setzt (siehe November 1999). So werden Cox-2-Hemmer als "Front- und Seiten-Airbag der zukünftigen NSAR-Therapie" propagiert (Ärzte Ztg. vom 29. März 2000) und weiterhin unerwünschte Effekte im Magen-Darm-Trakt "auf Plazeboniveau" behauptet (Ärzte Ztg. vom 5. Okt. 2000). Gleichzeitig wird versucht, den Begriff "zielgerichtete" Cox-2-Hemmung zu etablieren (z.B. Ärzte Ztg. vom 26. Jan. 2000 und 8. März 2000), der die vielfältigen Funktionen der Cox-Isoenzyme verschleiert. Dezember 2000: VIOXX ist ein Jahr nach Markteinführung bereits auf Rang 71 der meistverordneten Arzneimittel aufgerückt (siehe Dezember 2003), nicht zuletzt wegen des Marketings, das auf intensive Beschäftigung "habilitierter Pharmareferenten" setzt (siehe November 1999). So werden Cox-2-Hemmer als "Front- und Seiten-Airbag der zukünftigen NSAR-Therapie" propagiert (Ärzte Ztg. vom 29. März 2000) und weiterhin unerwünschte Effekte im Magen-Darm-Trakt "auf Plazeboniveau" behauptet (Ärzte Ztg. vom 5. Okt. 2000). Gleichzeitig wird versucht, den Begriff "zielgerichtete" Cox-2-Hemmung zu etablieren (z.B. Ärzte Ztg. vom 26. Jan. 2000 und 8. März 2000), der die vielfältigen Funktionen der Cox-Isoenzyme verschleiert.
 Februar 2001: Die FDA mahnt Pharmacia (USA) ab, weil bei Telefonkonferenzen mit Ärzten wesentliche Risiken von Celecoxib - z.B. bedrohliche Magen-Darm-Schäden, Unverträglichkeit wegen Sulfonamidstruktur - verschwiegen und unbelegte Vorteile gegenüber anderen NSAR behauptet wurden (a-t 2001; 32: 35-6). Februar 2001: Die FDA mahnt Pharmacia (USA) ab, weil bei Telefonkonferenzen mit Ärzten wesentliche Risiken von Celecoxib - z.B. bedrohliche Magen-Darm-Schäden, Unverträglichkeit wegen Sulfonamidstruktur - verschwiegen und unbelegte Vorteile gegenüber anderen NSAR behauptet wurden (a-t 2001; 32: 35-6).
Ein Beraterkomitee der FDA kommt nach Auswertung sämtlicher, auch der nicht veröffentlichten Daten der CLASS-Studie zu dem Schluss, dass Celecoxib hinsichtlich gastrointestinaler Toxizität und globaler Verträglichkeit keine Vorteile gegenüber herkömmlichen NSAR besitzt. Ischämische kardiovaskuläre Ereignisse wie Angina pectoris, Herzinfarkt und Vorhofflimmern kommen demnach auch unter Celecoxib häufiger vor als unter klassischen NSAR. Dies verstärkt die pharmakologisch begründeten Bedenken, dass Coxibe als Wirkstoffgruppe das Risiko thromboembolischer kardiovaskulärer Ereignisse steigern könnten (a-t 2001; 32: 35-6).
 August 2001: Amerikanische Kardiologen weisen erneut auf die Herz-Kreislauf-Schädlichkeit von Coxiben hin (MUKHERJEE, D. et al.: JAMA 2001; 286: 954-9). Vergleicht man ein von dieser Arbeitsgruppe herangezogenes Review der FDA zur kardiovaskulären Sicherheit von Rofecoxib mit den veröffentlichten Daten der VIGOR-Studie, wird deutlich, dass in der Publikation von vornherein wesentliche Risikodaten verschwiegen wurden. Unseren Bericht über diese Datenmanipulation im blitz-a-t vom 31. Aug. 2001 weist MSD als angeblich "unwahr und damit unberechtigt" zurück (MSD: Fax vom 5. Sept. 2001). Gleichzeitig lässt die Firma durchblicken, wie massiv sie an der Publikation beteiligt war: "Seitens des Unternehmens wurde für die Publikation ... bewusst ein so genanntes ,Peer Review Journal' gewählt...". Es erscheint ungewöhnlich, dass der Hersteller des Prüfpräparates und nicht die Autoren den Veröffentlichungsort bestimmen. August 2001: Amerikanische Kardiologen weisen erneut auf die Herz-Kreislauf-Schädlichkeit von Coxiben hin (MUKHERJEE, D. et al.: JAMA 2001; 286: 954-9). Vergleicht man ein von dieser Arbeitsgruppe herangezogenes Review der FDA zur kardiovaskulären Sicherheit von Rofecoxib mit den veröffentlichten Daten der VIGOR-Studie, wird deutlich, dass in der Publikation von vornherein wesentliche Risikodaten verschwiegen wurden. Unseren Bericht über diese Datenmanipulation im blitz-a-t vom 31. Aug. 2001 weist MSD als angeblich "unwahr und damit unberechtigt" zurück (MSD: Fax vom 5. Sept. 2001). Gleichzeitig lässt die Firma durchblicken, wie massiv sie an der Publikation beteiligt war: "Seitens des Unternehmens wurde für die Publikation ... bewusst ein so genanntes ,Peer Review Journal' gewählt...". Es erscheint ungewöhnlich, dass der Hersteller des Prüfpräparates und nicht die Autoren den Veröffentlichungsort bestimmen.
Der Vorwurf der unvollständigen und somit manipulierten Datenwiedergabe bleibt: In der Publikation der Studie (siehe November 2000) berichteten die Autoren nur über einzelne kardiovaskuläre Komplikationen, nicht aber über die Gesamtrate. Ein signifikanter Unterschied zu Naproxen ergibt sich bei dieser Darstellung nur hinsichtlich der Herzinfarktrate sowie nur in der kleinen Untergruppe der Patienten, die wegen kardiovaskulärer Vorerkrankungen ASS benötigt hätten, aber laut Studienprotokoll diese nicht einnehmen durften. Dies legt die Interpretation nahe, dass Rofecoxib für Patienten ohne Indikation für ASS keine Gefahr berge. Aus den oben erwähnten Sicherheitsdaten geht jedoch hervor, dass schwere thrombotische kardiovaskuläre Ereignisse insgesamt, darunter neben Herzinfarkten auch Schlaganfall oder plötzlicher Tod, bei Patienten ohne ASS-Indikation unter Rofecoxib ebenfalls signifikant häufiger vorkommen. Das relative Risiko (RR) steigt bei diesen Patienten auf 1,89 (95% Konfidenzintervall [CI] 1,03 bis 3,45). Bei den Patienten mit ASS-Indikation erhöht es sich sogar auf das Fünffache (RR 4,89; 95% CI 1,41 bis 16,88), in der Gesamtgruppe auf 2,38 (95% CI 1,39 bis 4,00; a-t 2001; 32: 87-8).
In dem Review fallen auch die Ergebnisse der nur sechswöchigen plazebokontrollierten Studie 090 auf, in der bei insgesamt 978 Patienten mit Kniearthrose 12,5 mg Rofecoxib gegen 1.000 mg Nabumeton (ARTHAXAN, hierzulande nicht mehr im Handel) bzw. Plazebo verglichen werden. In der Rofecoxib-Gruppe finden sich numerisch häufiger schwere kardiovaskuläre Ereignisse (N = 6) einschließlich Myokardinfarkt bzw. Schlaganfall im Vergleich zu Nabumeton (2) oder Plazebo (1). Auch Therapieabbrüche wegen Herz-Kreislauf-Reaktionen sind in der Rofecoxib-Gruppe auffällig häufig (TARGUM, S.L. [FDA]: Cardiovascular Safety Review of Rofecoxib, 1. Febr. 2001; http://www.fda.gov/ohrms/dockets/ac/01/briefing/3677b2_06_ cardio.pdf).
Wegen der eindeutigen Zunahme von Myokardinfarkten unter Rofecoxib und einer numerischen, allerdings nicht signifikanten Zunahme unter Celecoxib in der CLASS-Studie werden prospektive klinische Studien gefordert, um gezielt das kardiovaskuläre Risiko von Coxiben zu überprüfen und die Größenordnung zu bestimmen (MUKHERJEE, D. et al.: JAMA 2001; 286: 954-9). Solche Studien wurden jedoch bislang nicht durchgeführt. Dabei hätten sie nur einen Bruchteil der mehr als 100 Millionen Dollar gekostet, die Merck & Co. in den USA pro Jahr für Direktwerbung beim Verbraucher (DTC, meist TV-Werbung) aufgewendet hat.
Auch den Autoren der CLASS-Studie wird zu diesem Zeitpunkt gezielte Irreführung vorgeworfen. Zur Veröffentlichung im JAMA wurden nur die Ergebnisse aus den ersten sechs Monaten der Studie mit Celecoxib eingereicht. Der Verfasser des begleitenden Editorials erhielt ebenfalls nur die Halbjahresdaten, obgleich die Studie in Wirklichkeit ein ganzes Jahr lang lief und zum Zeitpunkt der Publikation auch schon abgeschlossen war. Die Rate der Ulkuskomplikationen in den ersten sechs Monaten wurde in der Originalpublikation rechnerisch auf ein Jahr extrapoliert ("annualized incidence rates"). Insgesamt ergab sich dabei nur ein Trend zugunsten von Celecoxib im Vergleich mit Diclofenac bzw. Ibuprofen und ein signifikant besseres Ergebnis nur bei Patienten, die keine ASS eingenommen haben. Die tatsächlichen Ergebnisse nach einem Jahr, die nur der FDA mitgeteilt wurden, lassen dagegen keinen Vorteil von Celecoxib erkennen. In der zweiten Studienhälfte treten fast alle Ulkuskomplikationen in der Celecoxib-Gruppe auf.
Die Strategie der Datenunterdrückung in VIGOR und CLASS "lässt sich unseres Erachtens nur so erklären, dass sie den Herstellern einen zeitlichen Vorsprung verschaffen sollte, um ihre Produkte auf dem Markt zu etablieren" (a-t 2001; 32: 87-8).
Solche Scheininnovationen behindern den therapeutischen Fortschritt, da sie Gelder verschlingen, mit denen echte therapeutische Fortschritte finanziert werden könnten. Wir haben daher eine Negativliste für Scheininnovationen vorgeschlagen: Bezogen auf das Jahr 2000 hätten von den Ausgaben für Celecoxib und Rofecoxib 88% des Umsatzes von 240 Millionen DM, also 210 Mio. DM, durch Verordnung eines bewährten konventionellen NSAR freigestellt werden können (a-t 2001; 32: 77-9).
 September 2001: Zwei kleine Studien bestätigen, dass die Cox-2-Hemmer Celecoxib und Rofecoxib hinsichtlich nierenschädigender Effekte keinen Vorteil gegenüber herkömmlichen NSAR wie Indometazin (INDO VON CT u.a.) oder Naproxen besitzen. Unter beiden Cox-2-Hemmern ist bei einigen Hochdruckpatienten deutlicher Blutdruckanstieg beschrieben (a-t 2001; 32: 95). September 2001: Zwei kleine Studien bestätigen, dass die Cox-2-Hemmer Celecoxib und Rofecoxib hinsichtlich nierenschädigender Effekte keinen Vorteil gegenüber herkömmlichen NSAR wie Indometazin (INDO VON CT u.a.) oder Naproxen besitzen. Unter beiden Cox-2-Hemmern ist bei einigen Hochdruckpatienten deutlicher Blutdruckanstieg beschrieben (a-t 2001; 32: 95).
 Die FDA mahnt den Rofecoxib-Hersteller Merck & Co ab wegen "falscher, unausgewogener oder irreführender" Behauptungen: "Herunterspielen potenzieller Risiken und unzureichende Angaben zum Sicherheitsprofil von VIOXX werfen signifikante Bedenken hinsichtlich ... der Sicherheit auf." So werden potenzielle prothrombotische Risiken von Rofecoxib durch die Werbung bagatellisiert, indem die im Vergleich zu Naproxen fünffach erhöhte Herzinfarktrate mit einer "kardioprotektiven" Wirksamkeit von Naproxen erklärt wird (siehe November 2000). Hierfür gibt es, so die FDA, keine Belege durch Studien. Auch die vom Hersteller behauptete bessere Gesamtverträglichkeit gegenüber anderen NSAR trifft nicht zu. Kommentar der FDA: "Ein solcher Vorteil ist nicht belegt. Tatsächlich kommen in der VIGOR-Studie schwere unerwünschte Wirkungen unter VIOXX häufiger vor als unter Naproxen (9,3% versus 7,8%)" (a-t 2001; 32: 102-3). Die FDA mahnt den Rofecoxib-Hersteller Merck & Co ab wegen "falscher, unausgewogener oder irreführender" Behauptungen: "Herunterspielen potenzieller Risiken und unzureichende Angaben zum Sicherheitsprofil von VIOXX werfen signifikante Bedenken hinsichtlich ... der Sicherheit auf." So werden potenzielle prothrombotische Risiken von Rofecoxib durch die Werbung bagatellisiert, indem die im Vergleich zu Naproxen fünffach erhöhte Herzinfarktrate mit einer "kardioprotektiven" Wirksamkeit von Naproxen erklärt wird (siehe November 2000). Hierfür gibt es, so die FDA, keine Belege durch Studien. Auch die vom Hersteller behauptete bessere Gesamtverträglichkeit gegenüber anderen NSAR trifft nicht zu. Kommentar der FDA: "Ein solcher Vorteil ist nicht belegt. Tatsächlich kommen in der VIGOR-Studie schwere unerwünschte Wirkungen unter VIOXX häufiger vor als unter Naproxen (9,3% versus 7,8%)" (a-t 2001; 32: 102-3).
 In Deutschland unterbleibt eine Abmahnung des Herstellers. Weder das Bundesinstitut für Arzneimittel und Medizinprodukte noch das für die Überwachung von MSD zuständige Bayerische Staatsministerium für Gesundheit erfüllen ihren gesetzlichen Auftrag. Sie beanstanden nicht die desinformierenden und Risiken verharmlosenden Behauptungen der Firma. MSD verbreitet hierzulande bis heute Versionen wie: Es "hat sich immer wieder gezeigt, dass nur gegenüber Naproxen das Herz-Kreislauf-Risiko erhöht war... VIOXX war sogar genau so sicher wie Plazebo" (OSCHMANN, S., Geschäftsführer MSD: zit. nach Berl. Ztg. vom 25. Okt. 2004). In Deutschland unterbleibt eine Abmahnung des Herstellers. Weder das Bundesinstitut für Arzneimittel und Medizinprodukte noch das für die Überwachung von MSD zuständige Bayerische Staatsministerium für Gesundheit erfüllen ihren gesetzlichen Auftrag. Sie beanstanden nicht die desinformierenden und Risiken verharmlosenden Behauptungen der Firma. MSD verbreitet hierzulande bis heute Versionen wie: Es "hat sich immer wieder gezeigt, dass nur gegenüber Naproxen das Herz-Kreislauf-Risiko erhöht war... VIOXX war sogar genau so sicher wie Plazebo" (OSCHMANN, S., Geschäftsführer MSD: zit. nach Berl. Ztg. vom 25. Okt. 2004).
 Dezember 2001: Nach zweijähriger Vermarktung nimmt VIOXX Rang 41 der meistverordneten Arzneimittel ein, das seit eineinhalb Jahren erhältliche CELEBREX Rang 211. Dezember 2001: Nach zweijähriger Vermarktung nimmt VIOXX Rang 41 der meistverordneten Arzneimittel ein, das seit eineinhalb Jahren erhältliche CELEBREX Rang 211.
 Januar 2002: Rofecoxib erhält beim Deutschen Hausärztetag die René-Schubert-Medaille, mit der therapeutische Innovationen ausgezeichnet werden, die besonders alten Menschen helfen sollen (Ärzte Ztg. vom 15. Januar 2002). Januar 2002: Rofecoxib erhält beim Deutschen Hausärztetag die René-Schubert-Medaille, mit der therapeutische Innovationen ausgezeichnet werden, die besonders alten Menschen helfen sollen (Ärzte Ztg. vom 15. Januar 2002).
 März 2002: Rofecoxib wird als VIOXX DOLOR in Deutschland auch gegen akuten Schmerz und Dysmenorrhö angeboten. Für das von MSD als "bedeutenden Fortschritt in der Therapie akuter Schmerzen" bezeichnete Produkt können wir keine Vorteile gegenüber bewährten und zudem deutlich preiswerteren NSAR erkennen. Die in der Fachinformation beschriebene perioperative Anwendung von Rofecoxib ist unzureichend belegt (a-t 2002; 33: 50). Zur Gefahr des akuten Nierenversagens siehe Mai 2002. März 2002: Rofecoxib wird als VIOXX DOLOR in Deutschland auch gegen akuten Schmerz und Dysmenorrhö angeboten. Für das von MSD als "bedeutenden Fortschritt in der Therapie akuter Schmerzen" bezeichnete Produkt können wir keine Vorteile gegenüber bewährten und zudem deutlich preiswerteren NSAR erkennen. Die in der Fachinformation beschriebene perioperative Anwendung von Rofecoxib ist unzureichend belegt (a-t 2002; 33: 50). Zur Gefahr des akuten Nierenversagens siehe Mai 2002.
 Mai 2002: Pharmacia bringt in Deutschland Mai 2002: Pharmacia bringt in Deutschland  Parecoxib (DYNASTAT) auf den Markt, den dritten Cox-2-Hemmer. Dieser soll ausschließlich zur parenteralen Kurzzeittherapie postoperativer Schmerzen dienen. Die Indikation erachten wir als Kontraindikation: NSAR einschließlich Cox-2-Hemmer beeinträchtigen die Autoregulation der Nierendurchblutung. Vor allem bei Blutverlusten und in Stresssituationen, insbesondere in den ersten Tagen nach einer Operation, ist damit die Gefahr eines akuten Nierenversagens verbunden. Geeignete Mittel für die postoperative Schmerztherapie bleiben die nierenverträglichen Opioide. Wir warnen zusätzlich: "Aufgrund der Sulfonamidstruktur ist - wie bei Celecoxib - mit Sulfonamidüberempfindlichkeitsreaktionen zu rechnen. Als Kontraindikation wird dies in der Fachinformation nicht erwähnt" (a-t 2002; 33: 62-3). Parecoxib (DYNASTAT) auf den Markt, den dritten Cox-2-Hemmer. Dieser soll ausschließlich zur parenteralen Kurzzeittherapie postoperativer Schmerzen dienen. Die Indikation erachten wir als Kontraindikation: NSAR einschließlich Cox-2-Hemmer beeinträchtigen die Autoregulation der Nierendurchblutung. Vor allem bei Blutverlusten und in Stresssituationen, insbesondere in den ersten Tagen nach einer Operation, ist damit die Gefahr eines akuten Nierenversagens verbunden. Geeignete Mittel für die postoperative Schmerztherapie bleiben die nierenverträglichen Opioide. Wir warnen zusätzlich: "Aufgrund der Sulfonamidstruktur ist - wie bei Celecoxib - mit Sulfonamidüberempfindlichkeitsreaktionen zu rechnen. Als Kontraindikation wird dies in der Fachinformation nicht erwähnt" (a-t 2002; 33: 62-3).
Die Arzneimittelkommission der deutschen Ärzteschaft stellt fest, dass "das Sicherheitsprofil der Cox-2-Inhibitoren bezüglich gastrointestinaler Nebenwirkungen gerade bei Risikopatienten erheblich geringer (ist) als angenommen. Bei Patienten mit einer Indikation zur ASS-Langzeitgabe ist ein Vorteil der Behandlung mit Cox-2-Inhibitoren gegenüber nichtselektiven NSAR nicht zu erkennen" (Dtsch. Ärztebl. 2002; 99 [22]: C1207).
 Juli 2002: Auf Veranlassung der französischen Arzneimittelbehörde soll die Sicherheit von Cox-2-Hemmern auf EU-Ebene überprüft werden, unter anderem wegen kardiovaskulärer Nebenwirkungen (Ergebnis siehe April 2004). Juli 2002: Auf Veranlassung der französischen Arzneimittelbehörde soll die Sicherheit von Cox-2-Hemmern auf EU-Ebene überprüft werden, unter anderem wegen kardiovaskulärer Nebenwirkungen (Ergebnis siehe April 2004).
Aus Frankreich stammen drei Berichte zu Torsade-de-pointes-Tachykardien ("chaotische Kammertachykardie") nach mehrtägiger Einnahme von Celecoxib (a-t 2002; 33: 88). In der Fachinformation von CELEBREX (Stand April 2004) fehlt bis heute ein Hinweis auf Rhythmusstörungen als unerwünschte Wirkung.
 Oktober 2002: Pharmacia stoppt vorübergehend den Vertrieb von Parecoxib, informiert die Fachkreise aber erst zweieinhalb Wochen danach. Die Produktinformationen von DYNASTAT müssen geändert werden, da in Verbindung mit Valdecoxib (USA: BEXTRA, in Deutschland erst ab Mai 2003 im Handel), dem aktiven Metaboliten von Parecoxib, lebensbedrohliche Überempfindlichkeitsreaktionen einschließlich Anaphylaxie, STEVENS-JOHNSON- und LYELL-Syndrom u.a. aufgetreten sind. Angesichts der Gefährdung durch schwere Unverträglichkeitsreaktionen und der Fehlindikation "postoperative Schmerztherapie" (siehe Mai 2002) warnen wir erneut vor der Verwendung von Parecoxib (a-t 2002; 33: 119). Oktober 2002: Pharmacia stoppt vorübergehend den Vertrieb von Parecoxib, informiert die Fachkreise aber erst zweieinhalb Wochen danach. Die Produktinformationen von DYNASTAT müssen geändert werden, da in Verbindung mit Valdecoxib (USA: BEXTRA, in Deutschland erst ab Mai 2003 im Handel), dem aktiven Metaboliten von Parecoxib, lebensbedrohliche Überempfindlichkeitsreaktionen einschließlich Anaphylaxie, STEVENS-JOHNSON- und LYELL-Syndrom u.a. aufgetreten sind. Angesichts der Gefährdung durch schwere Unverträglichkeitsreaktionen und der Fehlindikation "postoperative Schmerztherapie" (siehe Mai 2002) warnen wir erneut vor der Verwendung von Parecoxib (a-t 2002; 33: 119).
 Dezember 2002: MSD verweigert uns Informationen zu Störeffekten zu Rofecoxib: Auf Anfrage zu lichenoiden Exanthemen in Verbindung mit dem Cox-2-Hemmer bescheidet uns die Firma lapidar, "dass Detailinformationen hierzu ... nur an die Zulassungsbehörden gegeben werden" (a-t 2002; 33: 123-4). Dezember 2002: MSD verweigert uns Informationen zu Störeffekten zu Rofecoxib: Auf Anfrage zu lichenoiden Exanthemen in Verbindung mit dem Cox-2-Hemmer bescheidet uns die Firma lapidar, "dass Detailinformationen hierzu ... nur an die Zulassungsbehörden gegeben werden" (a-t 2002; 33: 123-4).
 Mai 2003: Pharmacia bringt Mai 2003: Pharmacia bringt  Valdecoxib (BEXTRA), den aktiven Metaboliten des Parenteralcoxibs Parecoxib, in den Handel. Auch für das vierte Coxib können wir weder einen Wirksamkeits- noch einen Sicherheitsvorteil ausmachen. Eine Senkung der Rate gastrointestinaler Komplikationen ist nicht belegt. Schwere Überempfindlichkeitsreaktionen und Hautschäden erforderten zuvor bereits in den USA Verschärfungen der Produktinformationen. In höheren Dosierungen scheint Valdecoxib nierenschädlicher zu sein als konventionelle NSAR und häufiger mit schweren kardiovaskulären Ereignissen einherzugehen (a-t 2003; 34: 42). Valdecoxib (BEXTRA), den aktiven Metaboliten des Parenteralcoxibs Parecoxib, in den Handel. Auch für das vierte Coxib können wir weder einen Wirksamkeits- noch einen Sicherheitsvorteil ausmachen. Eine Senkung der Rate gastrointestinaler Komplikationen ist nicht belegt. Schwere Überempfindlichkeitsreaktionen und Hautschäden erforderten zuvor bereits in den USA Verschärfungen der Produktinformationen. In höheren Dosierungen scheint Valdecoxib nierenschädlicher zu sein als konventionelle NSAR und häufiger mit schweren kardiovaskulären Ereignissen einherzugehen (a-t 2003; 34: 42).
 August 2003: Auf der Basis von Nebenwirkungsmeldungen an das NETZWERK DER GEGENSEITIGEN INFORMATION berichten wir über akutes Nierenversagen unter Celecoxib und Rofecoxib. Nach Daten der FDA sollen Coxibe ein etwa gleich großes Risiko bergen wie herkömmliche NSAR. Besonders gefährdet sind Ältere und Patienten, die zusätzlich Diuretika und ACE-Hemmer (oder Angiotensin-II-Blocker) einnehmen sowie Personen mit vorbestehender eingeschränkter Nierenfunktion u.a. Bedenklich erscheint, dass Patienten mit Risikofaktoren für eine Nierenschädigung anscheinend deutlich häufiger Cox-2-Hemmer erhalten als andere NSAR (a-t 2003; 34: 79). August 2003: Auf der Basis von Nebenwirkungsmeldungen an das NETZWERK DER GEGENSEITIGEN INFORMATION berichten wir über akutes Nierenversagen unter Celecoxib und Rofecoxib. Nach Daten der FDA sollen Coxibe ein etwa gleich großes Risiko bergen wie herkömmliche NSAR. Besonders gefährdet sind Ältere und Patienten, die zusätzlich Diuretika und ACE-Hemmer (oder Angiotensin-II-Blocker) einnehmen sowie Personen mit vorbestehender eingeschränkter Nierenfunktion u.a. Bedenklich erscheint, dass Patienten mit Risikofaktoren für eine Nierenschädigung anscheinend deutlich häufiger Cox-2-Hemmer erhalten als andere NSAR (a-t 2003; 34: 79).
 September 2003: MSD erhält die "Goldene Tablette". Der angebliche "Pharma-Oscar" wird von einem Marktforschungsinstitut nach Befragung von lediglich 150 niedergelassenen Orthopäden für das Unternehmen mit "bestem Image und innovativstem Arzneimittel" vergeben (Ärzte Ztg. vom 22. Sept. 2003). Durch solche Befragungen wird unseres Erachtens lediglich die Aktivität des Firmen-Marketings abgebildet. Die "Goldene Tablette" erachten wir als typisches Beispiel für eine wertlose "Auszeichnung", mit der Pharmahersteller sich selbst feiern. September 2003: MSD erhält die "Goldene Tablette". Der angebliche "Pharma-Oscar" wird von einem Marktforschungsinstitut nach Befragung von lediglich 150 niedergelassenen Orthopäden für das Unternehmen mit "bestem Image und innovativstem Arzneimittel" vergeben (Ärzte Ztg. vom 22. Sept. 2003). Durch solche Befragungen wird unseres Erachtens lediglich die Aktivität des Firmen-Marketings abgebildet. Die "Goldene Tablette" erachten wir als typisches Beispiel für eine wertlose "Auszeichnung", mit der Pharmahersteller sich selbst feiern.
 November 2003: Die Datenmanipulationen bei Veröffentlichung der Coxib-Studien CLASS und VIGOR (siehe September 2001) waren im September 2002 Thema in der unabhängigen spanischen Pharmazeitschrift "butlletí groc" mit der Überschrift "Die so genannten Vorteile von Celecoxib und Rofecoxib: Wissenschaftlicher Betrug". Obwohl die Unterdrückung der Daten offensichtlich ist und weltweit diskutiert wird, bemüht MSD (Spanien) Juristen und verklagt jetzt die Herausgeber des Bulletins. Der beanstandete Artikel soll nicht nur zurückgezogen, sondern durch einen von der Firma geschriebenen ersetzt werden (a-t 2004; 35: 16). MSD verliert im Januar 2004 das Verfahren (GIBSON, L.: BMJ 2004; 328: 307). November 2003: Die Datenmanipulationen bei Veröffentlichung der Coxib-Studien CLASS und VIGOR (siehe September 2001) waren im September 2002 Thema in der unabhängigen spanischen Pharmazeitschrift "butlletí groc" mit der Überschrift "Die so genannten Vorteile von Celecoxib und Rofecoxib: Wissenschaftlicher Betrug". Obwohl die Unterdrückung der Daten offensichtlich ist und weltweit diskutiert wird, bemüht MSD (Spanien) Juristen und verklagt jetzt die Herausgeber des Bulletins. Der beanstandete Artikel soll nicht nur zurückgezogen, sondern durch einen von der Firma geschriebenen ersetzt werden (a-t 2004; 35: 16). MSD verliert im Januar 2004 das Verfahren (GIBSON, L.: BMJ 2004; 328: 307).
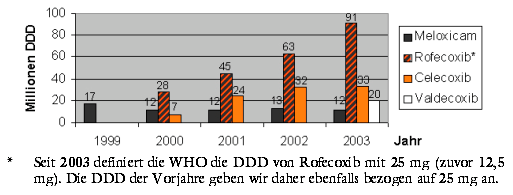
 Dezember 2003: Mit 91 Millionen definierten Tagesdosierungen (25 mg; siehe Abbildung) ist VIOXX 2003 auf Rang 16 der zu Lasten der Gesetzlichen Krankenversicherung meistverordneten Arzneimittel aufgerückt. CELEBREX nimmt Rang 180 und BEXTRA Rang 399 ein. Dezember 2003: Mit 91 Millionen definierten Tagesdosierungen (25 mg; siehe Abbildung) ist VIOXX 2003 auf Rang 16 der zu Lasten der Gesetzlichen Krankenversicherung meistverordneten Arzneimittel aufgerückt. CELEBREX nimmt Rang 180 und BEXTRA Rang 399 ein.
Abbildung: Entwicklung der Verordnungszahlen von Cox-2-Hemmern von 1999 bis 2003 zu Lasten der Gesetzlichen Krankenversicherung bezogen auf Millionen definierter Tagesdosierungen (DDD; nach SCHWABE, U., PAFFRATH, D. [Hrsg.]: "Arzneiverordnungs-Report" [2000 bis 2004], Springer Verlag Berlin 2000 bis 2004):>
 April 2004: Die europäische Arzneimittelbehörde EMEA schließt das im Juli 2002 eingeleitete Verfahren zur Überprüfung der Sicherheit von Cox-2-Hemmern mit der Feststellung ab, dass das Nutzen-Risiko-Verhältnis für alle Cox-2-Hemmer "weiterhin positiv" sei. Das Risiko schwerer gastrointestinaler Schädigungen (Perforationen, Ulzera, Blutungen) wird als "vergleichbar" mit dem von Diclofenac, Ibuprofen u.a. eingestuft. Patienten mit Risikofaktoren (z.B. höheres Lebensalter, frühere gastrointestinale Schädigung) "sind mehr gefährdet", Coxibe sollten daher - wie andere NSAR - "bei diesen Patienten mit Vorsicht" angewendet werden. Die Einnahme einiger Coxibe (Rofecoxib oder Etoricoxib versus Naproxen bzw. tendenziell Celecoxib versus Naproxen oder Diclofenac) könne im Vergleich zu konventionellen NSAR "mit einem erhöhten Risiko für das Auftreten von Herzinfarkten verbunden sein" (Entscheidung der Europäischen Kommission vom 30. Apr. 2004; http://www.bfarm.de/de/Arzneimittel/am_sicher/am_sicher_akt/index.php?more=coxibe.php). Beipackzettel und Fachinformationen werden entsprechend angepasst. Eine Überprüfung der kardiovaskulären Verträglichkeit durch geeignete prospektive Studien fordert die Behörde nicht. April 2004: Die europäische Arzneimittelbehörde EMEA schließt das im Juli 2002 eingeleitete Verfahren zur Überprüfung der Sicherheit von Cox-2-Hemmern mit der Feststellung ab, dass das Nutzen-Risiko-Verhältnis für alle Cox-2-Hemmer "weiterhin positiv" sei. Das Risiko schwerer gastrointestinaler Schädigungen (Perforationen, Ulzera, Blutungen) wird als "vergleichbar" mit dem von Diclofenac, Ibuprofen u.a. eingestuft. Patienten mit Risikofaktoren (z.B. höheres Lebensalter, frühere gastrointestinale Schädigung) "sind mehr gefährdet", Coxibe sollten daher - wie andere NSAR - "bei diesen Patienten mit Vorsicht" angewendet werden. Die Einnahme einiger Coxibe (Rofecoxib oder Etoricoxib versus Naproxen bzw. tendenziell Celecoxib versus Naproxen oder Diclofenac) könne im Vergleich zu konventionellen NSAR "mit einem erhöhten Risiko für das Auftreten von Herzinfarkten verbunden sein" (Entscheidung der Europäischen Kommission vom 30. Apr. 2004; http://www.bfarm.de/de/Arzneimittel/am_sicher/am_sicher_akt/index.php?more=coxibe.php). Beipackzettel und Fachinformationen werden entsprechend angepasst. Eine Überprüfung der kardiovaskulären Verträglichkeit durch geeignete prospektive Studien fordert die Behörde nicht.
 Mai 2004: In der aktuellen Fachinformation von VIOXX wird in der Rubrik "Nebenwirkungen" bei den Einträgen Myokardinfarkt und zerebrovaskulärer Insult der Kommentar "Kausalzusammenhang nicht nachgewiesen" gestrichen. Folgende Angaben bzw. Änderungen der Einträge zu kardiovaskulären Nebenwirkungen werden seit Markteinführung in VIOXX-Fachinformationen vorgenommen: Mai 2004: In der aktuellen Fachinformation von VIOXX wird in der Rubrik "Nebenwirkungen" bei den Einträgen Myokardinfarkt und zerebrovaskulärer Insult der Kommentar "Kausalzusammenhang nicht nachgewiesen" gestrichen. Folgende Angaben bzw. Änderungen der Einträge zu kardiovaskulären Nebenwirkungen werden seit Markteinführung in VIOXX-Fachinformationen vorgenommen:

Es fällt auf, dass die Häufigkeitsangaben bis zuletzt im Widerspruch zur Studienlage stehen. In der VIGOR-Studie beispielsweise traten unter Rofecoxib 20 akute Myokardinfarkte auf. Bezogen auf die 4.047 Patienten entsprechen diese 0,5% (laut Definition also gelegentlich [0,1-1%]). Die Angabe von MSD mit "sehr selten" (definiert als weniger als 1 : 10.000 [also unter 0,01%]) liegt im Vergleich zu VIGOR mindestens um eine Zehnerpotenz zu niedrig.
 Juli 2004: Eine Querschnittserhebung aus Kanada legt nahe, dass die unkritische Verwendung von Coxiben zu einer Häufung schwerer Magen-Darm-Komplikationen führt. Die auf Verordnungsdaten und Krankenhausdiagnosen basierende Erhebung lässt erkennen, dass die Verordnung von Cox-2-Hemmern unter der fälschlichen Annahme einer besseren gastrointestinalen Verträglichkeit Risikopatienten gefährdet (a-t 2004; 35: 73). Juli 2004: Eine Querschnittserhebung aus Kanada legt nahe, dass die unkritische Verwendung von Coxiben zu einer Häufung schwerer Magen-Darm-Komplikationen führt. Die auf Verordnungsdaten und Krankenhausdiagnosen basierende Erhebung lässt erkennen, dass die Verordnung von Cox-2-Hemmern unter der fälschlichen Annahme einer besseren gastrointestinalen Verträglichkeit Risikopatienten gefährdet (a-t 2004; 35: 73).
 15. September 2004: MSD bringt 15. September 2004: MSD bringt  Etoricoxib (ARCOXIA) in den Handel. Dieses fünfte Coxib besitzt in seiner chemischen Struktur Ähnlichkeiten mit Rofecoxib. Belege für Nutzen- oder Verträglichkeitsvorteile finden wir bei Markteinführung nicht. In Studien sind unter Etoricoxib Herzinfarkt, transitorische Ischämie, Angina pectoris und Lungenembolie vorgekommen, ein möglicher Zusammenhang mit den Arzneimitteln wird von den gesponserten Prüfärzten jedoch verneint. Das Risiko thrombotischer kardiovaskulärer Ereignisse einschließlich Herzinfarkt und Schlaganfall ist für die Neuerung nicht unzureichend untersucht. Wir raten von der Anwendung ab (a-t 2004; 35: 103-4). Etoricoxib (ARCOXIA) in den Handel. Dieses fünfte Coxib besitzt in seiner chemischen Struktur Ähnlichkeiten mit Rofecoxib. Belege für Nutzen- oder Verträglichkeitsvorteile finden wir bei Markteinführung nicht. In Studien sind unter Etoricoxib Herzinfarkt, transitorische Ischämie, Angina pectoris und Lungenembolie vorgekommen, ein möglicher Zusammenhang mit den Arzneimitteln wird von den gesponserten Prüfärzten jedoch verneint. Das Risiko thrombotischer kardiovaskulärer Ereignisse einschließlich Herzinfarkt und Schlaganfall ist für die Neuerung nicht unzureichend untersucht. Wir raten von der Anwendung ab (a-t 2004; 35: 103-4).
 23. September 2004: Das firmenunabhängige externe Safety Monitoring Board empfiehlt den Abbruch der APPROVe***-Studie. Die randomisierte plazebokontrollierte Studie sollte den Einfluss der auch in der Rheumatherapie üblichen Tagesdosis von 25 mg Rofecoxib auf das Wiederauftreten von Dickdarmpolypen prüfen. Ab dem 18. Einnahmemonat fällt jedoch in der Rofecoxib-Gruppe eine Zunahme kardio- und zerebrovaskulärer Ereignisse auf (Herzinfarkte, Schlaganfälle u.a.). Nach vorläufigen Auswertungen stehen 25 bestätigten Komplikationen pro 3.315 Patientenjahre unter Plazebo 45 Ereignissen pro 3.041 Patientenjahre unter Rofecoxib gegenüber (0,75 Ereignisse pro 100 Patientenjahre versus 1,48/100). Das relative Risiko beträgt 1,96 (95% Konfidenzintervall 1,20 bis 3,19). Dies bedeutet eine Verdoppelung des Risikos kardio- und zerebrovaskulärer Erkrankungen (a-t 2004; 35: 116). Bezogen auf eine Tagesdosis von 25 mg bedeutet dies hochgerechnet, dass hierzulande in Verbindung mit Rofecoxib pro Jahr 2.000 Patienten kardiovaskuläre Ereignisse wie Herzinfarkt und Schlaganfall erlitten haben könnten. 23. September 2004: Das firmenunabhängige externe Safety Monitoring Board empfiehlt den Abbruch der APPROVe***-Studie. Die randomisierte plazebokontrollierte Studie sollte den Einfluss der auch in der Rheumatherapie üblichen Tagesdosis von 25 mg Rofecoxib auf das Wiederauftreten von Dickdarmpolypen prüfen. Ab dem 18. Einnahmemonat fällt jedoch in der Rofecoxib-Gruppe eine Zunahme kardio- und zerebrovaskulärer Ereignisse auf (Herzinfarkte, Schlaganfälle u.a.). Nach vorläufigen Auswertungen stehen 25 bestätigten Komplikationen pro 3.315 Patientenjahre unter Plazebo 45 Ereignissen pro 3.041 Patientenjahre unter Rofecoxib gegenüber (0,75 Ereignisse pro 100 Patientenjahre versus 1,48/100). Das relative Risiko beträgt 1,96 (95% Konfidenzintervall 1,20 bis 3,19). Dies bedeutet eine Verdoppelung des Risikos kardio- und zerebrovaskulärer Erkrankungen (a-t 2004; 35: 116). Bezogen auf eine Tagesdosis von 25 mg bedeutet dies hochgerechnet, dass hierzulande in Verbindung mit Rofecoxib pro Jahr 2.000 Patienten kardiovaskuläre Ereignisse wie Herzinfarkt und Schlaganfall erlitten haben könnten.
*** |
APPROVe = Adenomatous Polyp Prevention on VIOXX
|
 30. September 2004: Die Daten der APPROVe-Studie lassen keinen Zweifel mehr am schädigenden Potenzial von Rofecoxib. Die Firma MSD, die zuvor die Hinweise auf kardiovaskuläre Schadwirkungen des Coxibs ignoriert beziehungsweise bagatellisiert hat, entscheidet sich jetzt zur sofortigen weltweiten Marktrücknahme von Rofecoxib. Damit dürfte MSD auch versucht haben, kostspielige Schadenersatzforderungen gering zu halten. Die ersten Sammelklagen gegen die Firma werden jedoch in den USA bereits Stunden nach dem Vertriebsstopp eingereicht. Wie vor drei Jahren Bayer beim Absturz des Lipidsenkers Cerivastatin (LIPOBAY; a-t 2001; 32: 88-9) gerät auch MSD bei den Fachkreisen in Misskredit, weil zuerst die Aktienhändler informiert werden. In Deutschland trennt sich der Konzern durch die Marktrücknahme von einem Jahresumsatz von 115 Millionen € für VIOXX und 5 Millionen € für VIOXX DOLOR (Daten für 2003, bezogen auf Herstellerabgabepreise und Verkäufe über öffentliche Apotheken). In Deutschland war VIOXX mit mehr als einem Fünftel des Firmenumsatzes das umsatzstärkste MSD-Produkt (blitz-a-t vom 30. Sept. 2004). Weltweit wird der Umsatz von VIOXX mit 2,5 Milliarden Dollar angegeben. Der Aktienkurs der Firma bricht zeitweilig um mehr als 25% ein. 30. September 2004: Die Daten der APPROVe-Studie lassen keinen Zweifel mehr am schädigenden Potenzial von Rofecoxib. Die Firma MSD, die zuvor die Hinweise auf kardiovaskuläre Schadwirkungen des Coxibs ignoriert beziehungsweise bagatellisiert hat, entscheidet sich jetzt zur sofortigen weltweiten Marktrücknahme von Rofecoxib. Damit dürfte MSD auch versucht haben, kostspielige Schadenersatzforderungen gering zu halten. Die ersten Sammelklagen gegen die Firma werden jedoch in den USA bereits Stunden nach dem Vertriebsstopp eingereicht. Wie vor drei Jahren Bayer beim Absturz des Lipidsenkers Cerivastatin (LIPOBAY; a-t 2001; 32: 88-9) gerät auch MSD bei den Fachkreisen in Misskredit, weil zuerst die Aktienhändler informiert werden. In Deutschland trennt sich der Konzern durch die Marktrücknahme von einem Jahresumsatz von 115 Millionen € für VIOXX und 5 Millionen € für VIOXX DOLOR (Daten für 2003, bezogen auf Herstellerabgabepreise und Verkäufe über öffentliche Apotheken). In Deutschland war VIOXX mit mehr als einem Fünftel des Firmenumsatzes das umsatzstärkste MSD-Produkt (blitz-a-t vom 30. Sept. 2004). Weltweit wird der Umsatz von VIOXX mit 2,5 Milliarden Dollar angegeben. Der Aktienkurs der Firma bricht zeitweilig um mehr als 25% ein.
 7. Oktober 2004: Die Firma Pfizer versucht, die Fachkreise mit einer breiten Werbekampagne von der angeblichen "kardialen Sicherheit" von Celecoxib und Valdecoxib zu überzeugen (Pfizer GmbH: "Marktrücknahme von VIOXX und VIOXX DOLOR", Rundschreiben vom 7. Okt. 2004). Die mit dem Schreiben verbreiteten Studien eignen sich jedoch nicht als Beleg der Verträglichkeit der Coxibe (blitz-a-t vom 15. Okt. 2004). Die Verträglichkeitsbehauptung hat zudem nur eine Halbwertszeit von einer Woche. Bereits am 15. Oktober muss Pfizer korrigieren, da in der ersten Stellungnahme zwei Studien mit Hochdosierungen von Valdecoxib bei Patienten mit Bypassoperationen übergangen worden sind, in denen vermehrt Schlaganfälle und Myokardinfarkte dokumentiert sind (Näheres siehe Seite 125). 7. Oktober 2004: Die Firma Pfizer versucht, die Fachkreise mit einer breiten Werbekampagne von der angeblichen "kardialen Sicherheit" von Celecoxib und Valdecoxib zu überzeugen (Pfizer GmbH: "Marktrücknahme von VIOXX und VIOXX DOLOR", Rundschreiben vom 7. Okt. 2004). Die mit dem Schreiben verbreiteten Studien eignen sich jedoch nicht als Beleg der Verträglichkeit der Coxibe (blitz-a-t vom 15. Okt. 2004). Die Verträglichkeitsbehauptung hat zudem nur eine Halbwertszeit von einer Woche. Bereits am 15. Oktober muss Pfizer korrigieren, da in der ersten Stellungnahme zwei Studien mit Hochdosierungen von Valdecoxib bei Patienten mit Bypassoperationen übergangen worden sind, in denen vermehrt Schlaganfälle und Myokardinfarkte dokumentiert sind (Näheres siehe Seite 125).
Nach dem Absturz von VIOXX schult Pfizer Pharmareferenten auf der Basis von Gesprächsvorlagen. Vorgeschlagener Text nach Musterabgabe: "Es liegt jetzt an Ihnen, Ihren VIOXX-Patienten eine sichere Therapie zu bieten:
- CELEBREX - für die Langzeittherapie gerade bei älteren Patienten
- BEXTRA - für die starke und schnelle Hilfe bei immer wiederkehrenden Schmerzen."
Einen Hinweis darauf, dass höheres Lebensalter auch bei Coxiben zu den Risikofaktoren für gastrointestinale Schädigungen gehört (siehe April 2004), finden wir in den Gesprächsübungen nicht.
 13. Oktober 2004: Der kommissarische Leiter des Bundesinstitut für Arzneimittel und Medizinprodukte, Prof. KURTH, sieht keine Versäumnisse bei VIOXX. "Es habe seit Ende 2000 nur vage Hinweise auf Kreislaufprobleme bei der Langzeitanwendung des Mittels gegeben" (Ärzte Ztg. vom 13. Okt. 2004). Diese angeblich "vagen Hinweise" haben immerhin in den USA zur Abmahnung der Firma durch die FDA (siehe September 2001) und international (einschließlich Deutschland) zur Korrektur der Fachinformationen geführt (siehe April 2004 und Mai 2004). 13. Oktober 2004: Der kommissarische Leiter des Bundesinstitut für Arzneimittel und Medizinprodukte, Prof. KURTH, sieht keine Versäumnisse bei VIOXX. "Es habe seit Ende 2000 nur vage Hinweise auf Kreislaufprobleme bei der Langzeitanwendung des Mittels gegeben" (Ärzte Ztg. vom 13. Okt. 2004). Diese angeblich "vagen Hinweise" haben immerhin in den USA zur Abmahnung der Firma durch die FDA (siehe September 2001) und international (einschließlich Deutschland) zur Korrektur der Fachinformationen geführt (siehe April 2004 und Mai 2004).
 20. Oktober 2004: Anscheinend sind auch innerhalb der FDA Bedenken hinsichtlich der Herz-Kreislauf-Schädlichkeit von Rofecoxib unterdrückt worden. Der Arzneimittelexperte der FDA GRAHAM, der eine noch nicht vollständig publizierte Fall-Kontroll-Studie mit negativem Ergebnis für Rofecoxib durchgeführt hat, beschreibt, dass es "extrem schwierig" sei, innerhalb der Behörde Sicherheitsbedenken zu äußern. Er geht von möglicherweise "über 27.000 Herzinfarkten und plötzlichen Herztodesfällen" durch die verbreitete Anwendung von Rofecoxib aus. Seine Folgerungen sind der FDA-Spitze offensichtlich zu scharf formuliert. Per E-Mail teilt ihm eine der FDA-Direktorinnen zudem mit, dass Merck & Co. gewarnt werden solle, bevor die Erkenntnisse öffentlich gemacht werden, "damit man sich dort auf die beträchtliche Medienresonanz einstellen könne" (AP 20. Okt. 2004: "FDA accused of silencing VIOXX warnings; Scrip 2004; Nr. 2996: 16; LENZER, J.: BMJ 2004; 329: 935). 20. Oktober 2004: Anscheinend sind auch innerhalb der FDA Bedenken hinsichtlich der Herz-Kreislauf-Schädlichkeit von Rofecoxib unterdrückt worden. Der Arzneimittelexperte der FDA GRAHAM, der eine noch nicht vollständig publizierte Fall-Kontroll-Studie mit negativem Ergebnis für Rofecoxib durchgeführt hat, beschreibt, dass es "extrem schwierig" sei, innerhalb der Behörde Sicherheitsbedenken zu äußern. Er geht von möglicherweise "über 27.000 Herzinfarkten und plötzlichen Herztodesfällen" durch die verbreitete Anwendung von Rofecoxib aus. Seine Folgerungen sind der FDA-Spitze offensichtlich zu scharf formuliert. Per E-Mail teilt ihm eine der FDA-Direktorinnen zudem mit, dass Merck & Co. gewarnt werden solle, bevor die Erkenntnisse öffentlich gemacht werden, "damit man sich dort auf die beträchtliche Medienresonanz einstellen könne" (AP 20. Okt. 2004: "FDA accused of silencing VIOXX warnings; Scrip 2004; Nr. 2996: 16; LENZER, J.: BMJ 2004; 329: 935).
 22. Oktober 2004: Die EMEA will erneut die kardiovaskuläre Sicherheit aller in der EU angebotenen Coxibe überprüfen, darunter auch das in Großbritannien u.a. vertriebene Lumiracoxib (PREXIGE). In der im August veröffentlichten TARGET****-Studie ließ sich - bezogen auf die veröffentlichten Daten - zwar kein signifikanter Unterschied in Bezug auf kardiovaskuläre Nebenwirkungen im Vergleich zu Naproxen oder Ibuprofen erkennen. Jedoch erleiden auch unter Lumiracoxib die Patienten numerisch häufiger einen Herzinfarkt (SCHNITZER, T.J. et al.: Lancet 2004; 364: 665-74). Das Ergebnis der fast zwei Jahre dauernden ersten Überprüfung der Coxibe ist erst seit Kurzem abgeschlossen (siehe April 2004). Fünf Jahre nach der Zulassung von Rofecoxib will die EMEA sich jetzt auch darüber Gedanken machen, "ob weitere Studien erforderlich sind" (EMEA, Press Release vom 22. Okt. 2004). Bis ein Ergebnis vorliegt, dürften wiederum Monate vergehen. 22. Oktober 2004: Die EMEA will erneut die kardiovaskuläre Sicherheit aller in der EU angebotenen Coxibe überprüfen, darunter auch das in Großbritannien u.a. vertriebene Lumiracoxib (PREXIGE). In der im August veröffentlichten TARGET****-Studie ließ sich - bezogen auf die veröffentlichten Daten - zwar kein signifikanter Unterschied in Bezug auf kardiovaskuläre Nebenwirkungen im Vergleich zu Naproxen oder Ibuprofen erkennen. Jedoch erleiden auch unter Lumiracoxib die Patienten numerisch häufiger einen Herzinfarkt (SCHNITZER, T.J. et al.: Lancet 2004; 364: 665-74). Das Ergebnis der fast zwei Jahre dauernden ersten Überprüfung der Coxibe ist erst seit Kurzem abgeschlossen (siehe April 2004). Fünf Jahre nach der Zulassung von Rofecoxib will die EMEA sich jetzt auch darüber Gedanken machen, "ob weitere Studien erforderlich sind" (EMEA, Press Release vom 22. Okt. 2004). Bis ein Ergebnis vorliegt, dürften wiederum Monate vergehen.
**** |
TARGET = Therapeutic Arthritis Research and Gastrointestinal Event Trial
|
 25. Oktober 2004: Die dänische Arzneimittelagentur schließt die beiden angebotenen Coxibe Celecoxib und Etoricoxib aus der generellen Erstattungsfähigkeit aus. Eine Erstattung ist nur noch auf namentlicher Basis möglich, wenn andere Therapien nicht wirksam sind oder nicht vertragen werden. Die Behörde betont, dass irrationaler Gebrauch zu der Entscheidung beigetragen hat, beispielsweise die breite Verwendung außerhalb der zugelassenen Indikationen (Scrip 2004; Nr. 2999: 6). 25. Oktober 2004: Die dänische Arzneimittelagentur schließt die beiden angebotenen Coxibe Celecoxib und Etoricoxib aus der generellen Erstattungsfähigkeit aus. Eine Erstattung ist nur noch auf namentlicher Basis möglich, wenn andere Therapien nicht wirksam sind oder nicht vertragen werden. Die Behörde betont, dass irrationaler Gebrauch zu der Entscheidung beigetragen hat, beispielsweise die breite Verwendung außerhalb der zugelassenen Indikationen (Scrip 2004; Nr. 2999: 6).
 1. November 2004: Das Wall Street Journal berichtet über interne E-Mails bei Merck & Co. Demzufolge diskutieren Firmenmitarbeiter bereits 1996/97, wie eine Studie so konzipiert werden könne, dass unter Rofecoxib möglichst wenige kardiovaskuläre Ereignisse auffallen, und vermuten 2000 anlässlich der VIGOR-Studie sogar einen Wirkmechanismus-abhängigen Schädigungsmechanismus (Seite siehe 117). Damit bricht die Argumentation der Firma, die Erkenntnisse aus der APPROVe-Studie zur Herzschädlichkeit seien "neu", endgültig zusammen. 1. November 2004: Das Wall Street Journal berichtet über interne E-Mails bei Merck & Co. Demzufolge diskutieren Firmenmitarbeiter bereits 1996/97, wie eine Studie so konzipiert werden könne, dass unter Rofecoxib möglichst wenige kardiovaskuläre Ereignisse auffallen, und vermuten 2000 anlässlich der VIGOR-Studie sogar einen Wirkmechanismus-abhängigen Schädigungsmechanismus (Seite siehe 117). Damit bricht die Argumentation der Firma, die Erkenntnisse aus der APPROVe-Studie zur Herzschädlichkeit seien "neu", endgültig zusammen.
|



