Wenig überrascht ein Rote-Hand-Brief der Firma Astra. Dem Risiko lebensbedrohlicher aplastischer Anämien des Neuroleptikums
Remoxiprid (ROXIAM) in der Größenordnung von 1 : 2.000 steht kein besonderer therapeutischer Nutzens entgegen. Die vom Hersteller
zunächst vorgesehenen Blutkontrollen und Einschränkungen der Anwendungsgebiete reichten nicht aus. Die von uns beantragte Marktrücknahme
(a-t 12 [1993], 135) erfolgte Ende Dezember 1993.
Vorprogrammiert erscheint der Absturz des als Analgetikum angebotenen nichtsteroidalen Entzündungshemmers Ketorolac (TORATEX). Als
"kostenintensives Luxusrisiko" stuften wir die Neueinführung ein und sehen im Gegensatz zur Zulassungsbehörde in der Indikation
"Akutbehandlung postoperativer Schmerzen" eine Gegenanzeige wegen des Risikos von Nierenversagen (a-t 7
[1992], 67). Ein Jahr später brachten Berichte über 90 Todesfälle in Verbindung mit Ketorolac, darunter Nierenversagen, Herz-Kreislauf- und
Leberschäden, das Aus für Ketorolac in Deutschland (a-t 6 [1993], 53 und 61; 7 [1993], 74; 8 [1993], 84).
Der Markteinführung des Sepsis-Antikörpers HA-1A (CENTOXIN) fehlte das Fundament: Bei Auswertung aller Studien ließ sich kein Vorteil
der Behandlung mit dem 7.000 DM pro Ampulle teuren Mittel gegenüber Plazebo feststellen (a-t 1 [1992], 2).
Nachdem CENTOXIN in den USA gar nicht erst zugelassen wurde (a-t 5 [1992], 47) und nach Zwischenanalyse einer
amerikanischen Phase-III-Studie mehr Patienten ohne gramnegative Bakteriämie unter CENTOXIN als unter Plazebo verstarben, nahm Lilly das Mittel Anfang
1993 vom Markt (a-t 3 [1993], 30).
Als Fiasko endet für Lilly in den USA die ambulante Erprobung neuer Virustatika gegen Hepatitis B. Fialuridin und sein Vorläufer Fialcytosin sind
Nukleosidanaloga von Zidovudin (AZT, RETROVIR), Didanosin (DDI, VIDEX), Zalcitabin (DDC, HIVID) und anderer bei AIDS eingesetzter Experimentalstoffe. Eine
Phase-II-Studie an 15 Patienten, bei der fünf Probanden mit chronischer Hepatitis starben, mußte wegen Leber- und Nierenschäden abgebrochen
werden. Die Studie begann mit Zustimmung der zuständigen Aufsichtsbehörde, obwohl kurz zuvor ein Phase-I-Versuch an 16 Probanden sichere
Hinweise auf Hepatotoxizität und Pankreasschäden gegeben hatte. Auch die Ergebnisse von Tierversuchen hätten die Anwendung von Fialuridin
beim Menschen ausgeschlossen. Schon bei einer Vorerprobung verstarben fünf Menschen (Scrip 1882 [1993], 8; 1883 [1993], 15). Der Versuchsleitung war es
offenbar nicht gelungen, die Ergebnisse verschiedener Tests auf einen gemeinsamen Nenner zu bringen.
Der Widerruf der Zulassung für 150 Krappwurzel (Rubiae tinctorum radix)-haltige Arzneimittel (a-t 4 [1993],
38) trifft den Phytopharmakabereich. Die in Krappwurzel enthaltenen Anthrachinonabkömmlinge Lucidin und Rubiadin gehören zu den stark
genotoxisch wirkenden Pflanzeninhaltsstoffen und erzeugen im Tierversuch bösartige Tumore. Das synthetische Anthrachinonderivat Dantron (ISTIZIN u.a.)
kam schon Jahre zuvor wegen kanzerogener Effekte vom Markt, während pflanzliche Anthrachinone in Abführmitteln heute noch angeboten werden (a-t 11 [1992], 111).
Weitere Maßnahmen zur Risikoabwehr sind für 1994 absehbar, für
- das neue Zusatzantiepileptikum Lamotrigin (LAMICTAL), das durch ausgeprägte immunogene Effekte einschließlich LYELL-/STEVENS-
JOHNSON-Syndrom auffällt (a-t 8 [1993], 78, 11 [1993], 128),
- das Ulkusmittel Omeprazol (ANTRA, GASTROLOC) wegen teils irreversibler Sehstörungen bis hin zur Blindheit (a-t 7 [1993], 74; 11 [1993], 122),
- das Migränemittel Sumatriptan (IMIGRAN), das gefährliche Gefäßspasmen einschließlich Herzinfarkt und Schlaganfall
auslösen kann (vgl. a-t 8 [1993], 84, 10 [1993], 100), den
Migräneanfall oft nur zeitlich verschiebt, aber nicht beseitigt (a-t 8 [1993], 81), eine Zunahme der Anfälle und
Abhängigkeit mit Notwendigkeit des stationären Entzugs erzeugen kann (OSBORNE, M. J. et al.: Brit. Med. J. 308 [1994], 113) und in für manche
Patienten überhöhter Dosierung angeboten wird (fehlende Mite-Formen; a-t 12 [1993], 134),
- die Gestoden-haltigen Kontrazeptiva FEMOVAN/MINULET wegen ihres im Vergleich zu anderen niedrigdosierten "Pillen" höheren
Risikos thromboembolischer Ereignisse (a-t 12 [1993], 136) und für
- Analgetika-Mischpräparate vom Typ des THOMAPYRIN (vgl. S. 16).
Die Marktrücknahme des nicht zuverlässig schützenden FSME-Immunglobulin FSME-BULIN, das wahrscheinlich sogar einen schweren
Verlauf der Erkrankung provozieren kann (a-t 12 [1993], 136), steht ebenso aus wie die Einschränkung des
Gebrauchs von FSME-Impfstoffen (FSME-IMMUN u.a.) auf Risikopersonen in Endemiegebieten (a-t 6 [1991],
50; 11 [1991], 105; 7 [1993], 65) und des mißbräuchlich
verwendeten gegen "Leistungsminderung" und niedrigen Blutdruck angebotenen Stimulans Prolintan (KATOVIT N; a-t 7 [1993], 65; 8 [1993], 82).
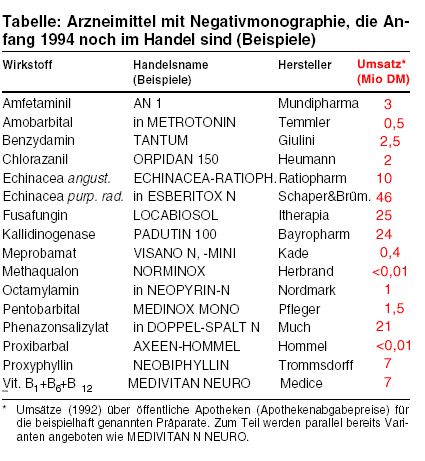
Für zahlreiche Wirkstoffe existieren Negativmonographien der Aufbereitungskommissionen beim Bundesgesundheitsamt, ohne daß der Marktrückzug
der betroffenen Fertigarzneimittel folgt (s. Tabelle). Belege der Wirksamkeit fehlen für Purpursonnenhutwurzel (in: ESBERITOX N u.a., Jahresumsatz
1992: 46 Millionen DM) und schmalblättriges Sonnenhutkraut (in ECHINACEA-RATIOPHARM u.a., 10 Mio. DM), für das in dem
Mischanalgetikum DOPPEL-SPALT N (21 Mio. DM) enthaltene Phenazonsalizylat, das Lokalantibiotikum Fusafungin (LOCABIOSOL, 25 Mio. DM;
a-t 11 [1993], 126) oder die gegen Fertilitätsstörungen angebotene Kallidinogenase (PADUTIN
100, 24 Mio. DM). Für die Theophyllin-Variante Proxyphyllin (in NEOBIPHYLLIN u.a.) ist das toxische Risiko ungeklärt. Die Behandlung
lebensbedrohlicher Asthmaformen mit NEOBIPHYLLIN erachten wir als Kunstfehler. Bei der Therapiekontrolle durch Bestimmung der Theophyllin-Plasmaspiegel
werden Varianten wie Proxyphyllin nicht mitgemessen (vgl. a-t 8 [1991], 70).
Das primäre Abhängigkeitspotential des Amphetamin-ähnlichen Stimulans Amfetaminil (AN 1) ist seit Jahrzehnten bekannt (a-t 6 [1972], 25; 8
[1988], 76). Eine Reihe ursprünglich beanspruchter Indikationen wie Angstzustände, Depressionen und Antriebsminderung bei Schizophrenien gelten
inzwischen als Kontraindikation. Der Nutzen für das nunmehr einzige ausgewiesene Anwendungsgebiet Narkolepsie wird nicht mit wissenschaftlichem
Erkenntnismaterial belegt. Überholt sind Meprobamat (VISANO u.a.) und Amobarbital (in METROTONIN) oder Pentobarbital
(MEDINOX MONO) (vgl. a-t 1 [1987]; 6, 7 [1989], 64). Wegen Abhängigkeitspotential und Gefahr der Kumulation aufgrund langer Halbwertszeit von rund einem
Tag (Amobarbital, Pentobarbital) und geringer therapeutischer Breite (Meprobamat) übersteigen Schadwirkungen einen möglichen Nutzen.
Unter den Neuzulassungen setzt sich der Trend zum Einstoffpräparat fort. Firmen behalten bei Produktveränderungen aus Marketinggründen
häufig den Handelsnamen bei, selbst wenn das Nachfolgepräparat nichts mehr mit dem Vorläufer gemein hat. So wurde aus der Theophyllin-haltigen
Asthmamittel-Kombination VITENUR ein Azetylzystein-Mono-Expektorans und aus dem Orphenadrin-Parazetamol-Muskelrelaxans SILENTAN
SPEZIAL das Einstoff-Analgetikum SILENTAN NEFOPAM 30.
Ein Allgemeinmediziner aus dem Stuttgarter Raum kommentiert seine Erfahrung mit der Sotalol-Hydrochlorothiazid-Kombination SOTAZIDEN:
"Ohne daß mir eine Änderung der Zusammensetzung bekanntgeworden wäre, wurde einem meiner Patienten in der Apotheke statt dessen das
völlig anders zusammengesetzte SOTAZIDEN N (Nadolol, Bendroflumethiazid) abgegeben, ohne daß dies auch vom Apotheker bemerkt worden
wäre." Die unbeabsichtigte Umstellung auf das völlig anders zusammengesetzte, aber fast gleichnamige SOTAZIDEN N ging bei einem
82jährigen mit "vermehrtem Schwindel, offensichtlich durch zu hohen Blutdruck" einher (NETZWERK-Bericht 6943). Gegen solche grundlegenden Veränderungen der Zusammensetzung unter Beibehaltung des Warenzeichens bleiben die
Überwachungsbehörden untätig. Ergänzungen des Warenzeichens durch "N" oder ähnliche Kürzel fallen bei oft
gleichbleibendem Packungsbild nicht auf. Mancher Anbieter entwickelt zudem Phantasie. Unsere Frage, warum TONUSTAB 100, das pro Tablette 5 mg
Etilefrin enthält, das Anhängsel 100 trägt, beantwortet der Hersteller lapidar: "100% Mono".
|

